Ein Filament geht durch die Wand
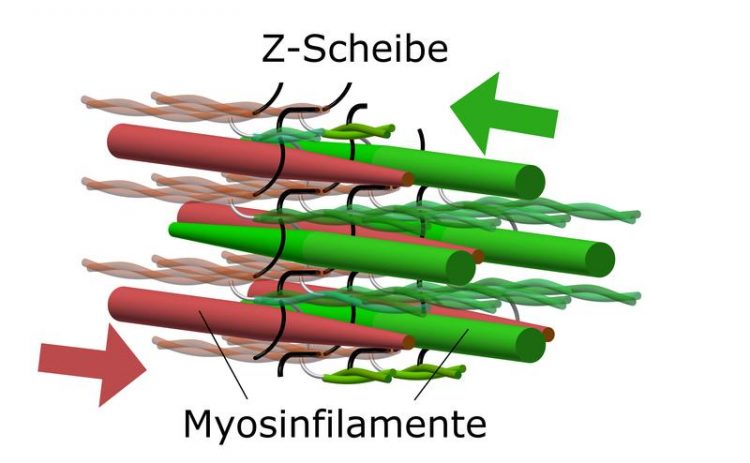
Ausschnitt der Mikrostruktur gestreifter Muskulatur: Die Myosinfilamente (rot und grün) zweier benachbarter Sarkomere durchdringen die maschenartige Struktur der sogenannten Z-Scheibe. Abbildung: Christian Rode/FSU
Die Physiologielehrbücher müssen überarbeitet werden: Die Kontraktion gestreifter Muskelfasern verläuft auf molekularer Ebene anders als bislang vermutet. Das berichten Bewegungswissenschaftler der Friedrich-Schiller-Universität Jena und der Universität Stuttgart.
In einer aktuellen Publikation in den „Proceedings of the Royal Society B“ präsentieren Dr. Christian Rode und seine Kollegen ein neuartiges Modell, das die Bewegungsabläufe der Muskelfilamente erstmals schlüssig erklärt und mit sämtlichen experimentellen Daten in Einklang bringt (DOI: 10.1098/rspb.2015.3030).
Muskeln sind die „Motoren“ all unserer Bewegungen. Egal ob wir nur leicht mit dem Finger übers Smartphone-Display wischen oder eine schwere Wasserkiste eine Treppe hinauftragen. Etwa 650 Muskeln arbeiten im menschlichen Körper und sie alle funktionieren nach demselben Prinzip. Wenn der Muskel kontrahiert, gleiten zwei Sorten langgestreckter Proteinmoleküle ineinander und verkürzen dabei den Muskel.
„Von großen Muskellängen kommend steigt die Kraft mit dem Überlappungsgrad beider Molekülketten an“, erläutert Bewegungswissenschaftler Dr. Christian Rode von der Universität Jena. Unter dem Mikroskop mit polarisiertem Licht betrachtet, verleihen die als Aktin und Myosin bezeichneten Moleküle der Muskulatur ein typisches Streifenmuster, weshalb die Skelett-Muskulatur auch als „gestreifte Muskulatur“ bezeichnet wird.
All dies ist seit vielen Jahrzehnten wissenschaftlicher Konsens und Bestandteil eines jeden Lehrbuchs zur Muskelphysiologie. Doch das bisherige Modell hat gravierende Lücken. „Zum Beispiel erzeugt der Muskel bei sehr kurzen Längen immer noch Kräfte, obwohl das nach der bisherigen Theorie nicht möglich ist“, so Dr. Rode. „Diese experimentell immer wieder bestätigten Befunde sind bislang aber ausgeklammert worden, eben weil man keine Erklärung für sie hatte.“
Gemeinsam mit Prof. Dr. Reinhard Blickhan, der den Jenaer Lehrstuhl für Bewegungswissenschaft innehat, und Kollegen der Uni Stuttgart unter Leitung von Prof. Dr. Tobias Siebert hat Rode nun ein Modell entwickelt und simuliert, das diese Daten erstmals schlüssig erklären kann.
Um das zu verstehen, ist ein weiterer Blick tief in die Mikrostruktur der Muskeln notwendig: Die kleinste funktionelle Einheit der Muskelfibrillen ist ein Sarkomer. Ein Sarkomer besteht aus Bündeln von Aktin und Myosinfäden, die an sogenannten Z-Scheiben verankert sind. Diese Z-Scheiben bilden gleichzeitig eine gitterartige Netzstruktur zwischen den Sarkomeren – ähnlich einem Maschendrahtzaun, der einzelne Grundstücke voneinander abgrenzt.
Wenn der Muskel kontrahiert und die Aktin- und Myosinfilamente ineinander gleiten, nähern sich benachbarte Z-Scheiben einander an. Sobald die maximale Überlappung erreicht ist, stoßen die steifen Myosinfilamente an der gegenüberliegenden Z-Scheibe an. Im Gegensatz zur bisherigen Lehrmeinung, wonach die Myosin-Filamente an den Z-Scheiben ungeordnet zusammengestaucht werden, schlagen die Forscher in ihrer nun vorgelegten Publikation einen alternativen Mechanismus vor.
„Die Myosinfilamente stoßen nicht an den Z-Scheiben an, sie dringen in ihre netzartige Struktur ein und gehen durch sie hindurch“, erklärt Christian Rode.
Nur so lasse sich erklären, warum der maximal verkürzte Muskel immer noch mehr Kraft erzeugt – die Myosinfilamente überlappen dafür mit den Aktinfilamenten im benachbarten Sarkomer. „Die Myosinmoleküle sind außerdem viel zu steif, um sich an den Z-Scheiben so zusammenzustauchen, wie es das herkömmliche Modell vorsah“, ist Dr. Rode überzeugt. Das von den Muskelforschern entwickelte und in der aktuellen Studie vorgestellte Modell ermögliche es nun erstmals, sämtliche strukturellen und funktionellen Befunde zur Muskelkontraktion in Einklang zu bringen. Davon versprechen sich die Wissenschaftler langfristig auch ein besseres Verständnis für bestimmte Muskelerkrankungen.
Original-Publikation:
Rode C et al. Myosin filament sliding through the Z-disc relates striated muscle fibre structure to function, Proceedings of the Royal Society B, 2016, DOI: 10.1098/rspb.2015.3030
Kontakt:
Dr. Christian Rode
Institut für Sportwissenschaft der Friedrich-Schiller-Universität Jena
Seidelstraße 20, 07749 Jena
Tel.: 03641 / 945704
E-Mail: christian.rode[at]uni-jena.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















