Dopamin hinterlässt Spuren im Hirnscanner
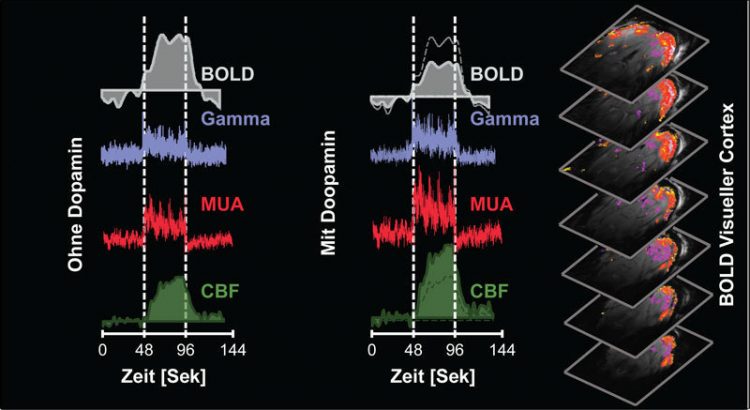
Dopamin verändert das sogenannte BOLD-Signal im MRT: Links: Ist die Sehrinde des Gehirns aktiv, steigt ohne Dopamin das BOLD-Signal an. Auch die Aktivität der Gamma-Wellen, einzelner Gruppen von Nervenzellen (MUA) sowie des Blutflusses in dem Areal (CBF) nimmt zu. Mitte: Unter dem Einfluss von Dopamin verringert sich das BOLD-Signal. Die Gamma-Wellen und die Aktivität der Nervenzellen bleibt jedoch konstant. Der Blutfluss steigt sogar. Rechts: Aktive Regionen (rot) in der Sehrinde des Gehirns. © MPI f. biologische Kybernetik/ D. Zaldivar
Um herauszufinden, welche Bereiche des Gehirns bei bestimmten Aufgaben aktiv werden, nutzen Forscher die funktionelle Magnetresonanztomografie (fMRT). Die Methode misst, in welchen Gebieten des Gehirns sich der Sauerstoffgehalt des Bluts ändert und zeigt damit indirekt an, welche Zellen gerade besonders aktiv sind.
Forschern vom Max-Planck-Institut für biologische Kybernetik in Tübingen zufolge verändern jedoch Signalmoleküle wie Dopamin die Arbeitsweise der Nervenzellen und führen dazu, dass fMRT-Signale allein nicht mehr das wahre Aktivitätsmuster widerspiegeln. In Kombination mit der Messung der Gehirndurchblutung ergeben sich wesentlich präzisere Daten.
Wer viel arbeitet, atmet schwer. So ist das auch bei den Nervenzellen. Wenn Neuronen feuern, verbrauchen sie Sauerstoff aus dem Blut. Damit es zu keinem Mangel kommt, wird sofort sauerstoffhaltiges Blut im Überfluss in die aktiven Gehirnregionen geschickt. Dadurch erhöht sich in diesen Gebieten der Sauerstoffgehalt des Bluts. Im Hirnscanner wird genau dieser Vorgang als sogenanntes BOLD-Signal gemessen. Steigt die Aktivität der Nervenzellen, steigt das BOLD-Signal. Soweit die Theorie.
Doch zahlreiche Faktoren wie Stimmung, Alter, Medikamente oder verschiedene kognitive Zustände wie Aufmerksamkeit, Gedächtnis oder Belohnung verändern BOLD-Signale und stören dadurch die Interpretation der Ergebnisse. „Es gibt keine hundertprozentige Korrelation zwischen Nervenzellaktivität und BOLD, weshalb wir die Signale aus Hirnscannern bisher nur unzureichend interpretieren können“, erklärt Daniel Zaldivar vom Max-Planck-Institut für biologische Kybernetik den Ausgangspunkt seiner Forschung. Gemeinsam mit Kollegen hat er bei Makaken untersucht, wie die Nervenzellen in der Sehrinde auf visuelle Reize reagieren, wenn das Gehirn gleichzeitig unter dem Einfluss von Dopamin steht. Das überraschende Ergebnis: Obwohl die Aktivität der Nervenzellen ansteigt, sinkt das BOLD-Signal um etwa 50 Prozent und gaukelt dem Betrachter eines Hirnscans somit vor, dass diese Neuronen weniger aktiv wären.
„Vermutlich führt das Dopamin dazu, dass von den aktiven Zellen mehr Sauerstoff verbraucht wird als mit dem Blut nachfließen kann“, erläutert Zaldivar. Paradoxerweise heizt Dopamin die Nervenzellaktivität also dermaßen an, dass das BOLD-Signal die entgegengesetzte Aussage liefert. Unter dem Einfluss von Neuromodulatoren und wahrscheinlich auch andere Neuromodulatoren, reichen Veränderungen des BOLD-Signals allein demnach nicht aus, um Rückschlüsse auf die Aktivität der Nervenzellen zu ziehen.
Erst in Verbindung mit Messungen der Gehirndurchblutung ergibt sich das wahre Bild. Denn unter dem Einfluss von Dopamin steigt den Wissenschaftlern zufolge auch der Blutfluss. Messungen der Hirndurchblutung in Kombination mit BOLD und neurophysiologischen Untersuchungen bieten folglich einen besseren Einblick in die Veränderungen des Energiestoffwechsels und erlauben dadurch zuverlässigere Aussage über die Aktivität von Nervenzellen.
„Wenn wir besser verstehen, wie sich BOLD-Signale unter dem Einfluss von Neuromodulatoren wie Dopamin verändern, können wir Hirnscans besser interpretieren und Störungen frühzeitig entdecken“, sagt Zaldivar. Ansonsten kann das bildgebende Verfahren zur falschen Behandlung führen, wenn ein Abfall des BOLD-Signals als Verringerung der Hirnaktivität verstanden wird.
Bei Schizophrenie-Patienten beispielsweise wird das Dopamin-System im Gehirn falsch reguliert. Wenn Wissenschaftler wissen, welchen Einfluss eine Dopamin-Schwemme auf die Bilder im Hirnscanner hat, könnte die Erkrankung frühzeitiger diagnostiziert werden. Das Gleiche trifft auch auf andere Neuromodulatoren zu. Die Ergebnisse der Wissenschaftler helfen dabei, die Diskrepanz zwischen der Änderung des Blutflusses und des Sauerstoffverbrauchs besser zu verstehen.
Ansprechpartner
Prof. Dr. Nikos K. Logothetis
Max-Planck-Institut für biologische Kybernetik, Tübingen
Telefon: +49 7071 601-651
Fax: +49 7071 601-652
E-Mail: nikos.logothetis@tuebingen.mpg.de
Dr. Daniel Zaldivar
Max-Planck-Institut für biologische Kybernetik, Tübingen
Telefon: +49 7071 601-657
E-Mail: Daniel.Zaldivar@tuebingen.mpg.de
Dr. Jozien Goense
Institute of Neuroscience & Psychology
University of Glasgow
E-Mail: Jozien.Goense@glasgow.ac.uk
Originalpublikation
Daniel Zaldivar, Alexander Rauch, Kevin Whittingstall, Nikos K. Logothetis, Jozien Goense
Dopamine-induced dissociation of BOLD and neural activity in macaque visual cortex
Current Biology, 20 November 2014
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















