Der „heilige Gral“ der Peptidchemie: Neue Strategie macht Peptid-Wirkstoffe oral verfügbar
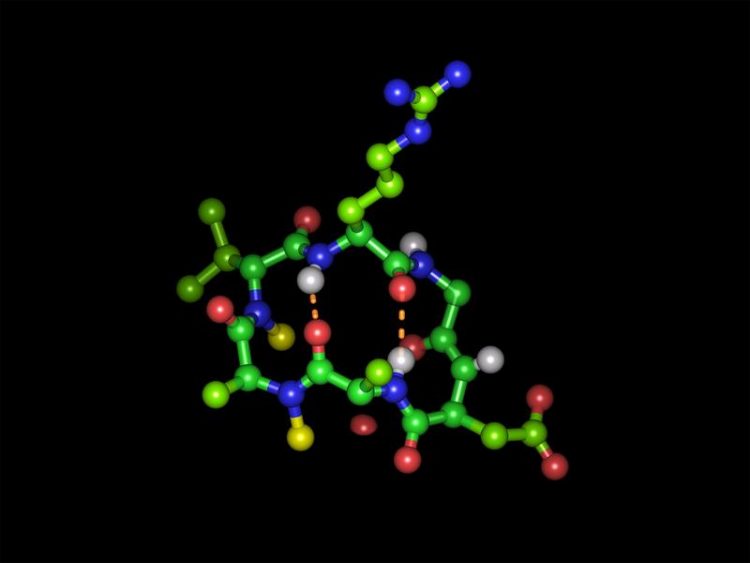
Cyclisches Hexapeptid in seiner bioaktiven Form mit der Integrin-bindenden Tripeptidsequenz Arginin-Glycin-Asparaginsäure Bild: Michael Weinmueller / TUM
Peptide sind kurze Aminosäureketten. Im menschlichen Körper steuern sie als Signalmoleküle vielfältige Funktionen. Bekannte Beispiele sind das Insulin, das aus 51 Aminosäurebausteinen besteht und den Zuckerstoffwechsel steuert oder Cyclosporin, ein Peptid aus elf Aminosäuren, das sich zur Unterdrückung der Abstoßungsreaktion bei Organtransplantationen bewährt hat.
„Peptide eignen sich wunderbar als Medikamente“, sagt Horst Kessler, Carl von Linde Professor am Institute for Advanced Study der TU München. „Der Körper nutzt sie ja bereits als Signalmoleküle, und wenn sie ihre Aufgabe erfüllt haben, können sie vom Körper recycelt werden – keine Anreicherung, keine aufwändige Entgiftung.“
Weltweit befinden sich daher derzeit rund 500 Peptid-basierte Medikamente in klinischen Tests. Einige wenige Peptid-Medikamente erzielen bereits Milliardenumsätze. Doch dass sie nicht in Tablettenform eingenommen werden können, ist ein entscheidender Nachteil fast aller Substanzen dieser Klasse.
Hürdenlauf
Da Eiweiße ein wichtiger Bestandteil der Nahrung sind, gibt es in Magen und Darm unzählige Enzyme, die Peptidbindungen spalten. Ungeschützt würde kein Peptid-Medikament den Durchgang durch den Magen-Darm-Trakt überstehen.
„Hier haben wir in den letzten Jahren einige wirksame Strategien entwickelt: Schwerer angreifbar sind beispielsweise ringförmige Peptide. Die Amidgruppen können mit Methylgruppen geschützt werden, und auch der Einbau von spiegelverkehrt aufgebauten D-Aminosäuren erschwert den Angriff der Verdauungsenzyme“, erläutert Kessler.
Doch kommen solchermaßen modifizierte Peptid-Verbindungen heil durch den Magen, steht ihnen eine weitere Hürde im Weg: Die Zellen der Darmwand verwehren ihnen die Aufnahme ins Blut. Spritzen ist daher in der Regel der einzige Weg, solche Wirkstoffe in den Körper zu bringen.
Der Weg durch die Wand
Diese Herausforderung ging das Team zunächst mit einem ringförmigen Modellpeptid an. Es bestand aus sechs Molekülen der einfachsten Aminosäure, dem Alanin. Damit untersuchten die Wissenschaftlerinnen und Wissenschaftler, wie sich der Ersatz von Wasserstoffatomen der Peptidbindungen durch Methylgruppen auf die orale Verfügbarkeit auswirkt.
Über 50 Variationen kamen so zustande. Zellversuche der Kooperationspartner in Israel zeigten, dass nur ganz bestimmte Peptid-Varianten sehr schnell aufgenommen werden. „Es sieht so aus, als könnten zyklische Hexapeptide mit einer bestimmten Struktur ein vorhandenes Transportsystem nutzen“, sagt Prof. Kessler.
Die biologische Wirkung
Als Ziel für ihre Peptide wählte des Team Integrin-Rezeptoren, die an der Zelloberfläche vielfältige Funktionen steuern. Eine Sequenz aus den drei Aminosäuren Arginin, Glycin und Asparaginsäure ist der Schlüssel für die Erkennung an diesen Rezeptoren. Kesslers Mitarbeiter bauten die Schlüsselsequenz an verschiedenen Positionen ihres Modellpeptids ein und schufen so neue Varianten.
Doch sowohl die negativ geladene Seitenkette der Asparaginsäure als auch das positiv geladene Arginin stellten sich als KO-Kriterium für die Nutzung des Transportsystems heraus. Dem Team gelang es jedoch, die geladenen Gruppen beider Aminosäuren mit Schutzgruppen zu maskieren.
Zwar verliert das Peptid damit zunächst die Fähigkeit zur Bindung an das Zielmolekül, doch wählt man die richtigen Schutzgruppen, so werden diese durch im Blut allgegenwärtige Enzyme wieder abspalten. Am Ziel angekommen ist die pharmazeutische Wirkung wiederhergestellt.
Beweis der oralen Verfügbarkeit
Zelltests bestätigten, dass das neue Hexapeptid eine biologische Wirkung aufweist: In niedriger Dosierung regt es das Wachstum von Blutgefäßen an. Füttert man Mäuse mit dem maskierten Hexapeptid, so stellt sich die gleiche Wirkung ein, wie bei Mäusen, denen das unmaskierte Hexapeptid gespritzt wurde.
„Experten haben in der Vergangenheit die orale Verfügbarkeit peptidbasierter Medikamente als den „heiligen Gral der Peptidchemie“ bezeichnet. Mit unserer Arbeit liefern wir eine Strategie, wie die Herausforderungen der Stabilität, der Aufnahme in den Körper und der biologischen Wirksamkeit gelöst werden können“, sagt Kessler. „In Zukunft wird es damit sehr viel leichter, Peptid-Medikamente herzustellen, die einfach als Saft oder Tablette gegeben werden können.“
Weitere Informationen:
Die Verbindungen wurden an der Technischen Universität München in Garching entworfen, synthetisiert und auf biologische Aktivität getestet, am CSIR-National Chemical Laboratory in Pune (Indien) und an der Università di Napoli Federico II in Italien strukturell charakterisiert. An Zellsystemen wurde in der Hebrew University in Jerusalem (Israel) die Permeabilität getestet und an der Queen Mary University of London (UK) die biologische Wirkung in Mäusen.
Die Arbeit wurde unterstützt durch Mittel der Deutschen Forschungsgemeinschaft (DFG) im Rahmen eines Reinhart Koselleck-Projekts und des Exzellenzclusters Center for Integrated Protein Science Munich (CIPSM) sowie des TUM-Institute for Advanced Study, das aus Mitteln der DFG und der Europäischen Union gefördert wird. Weitere Unterstützung erhielt das Projekt durch Worldwide Cancer Research und Cancer Research UK.
Die Bedeutung der Integrine
Die Kommunikation zwischen den Zellen eines Körpers in den verschiedenen Organen ist eine essenzielle Voraussetzung für die Existenz mehrzelliger Organismen. Eine wichtige Rolle spielen dabei Rezeptoren an der Zelloberfläche, die sogenannten Integrine. Sie leiten Informationen über die Umgebung der Zelle ins Zellinnere.
Tumore senden beispielsweise Wachstumssignale an Blutgefäßzellen, damit diese weiter wachsen und die Blutversorgung des Tumors sicherstellen. Fehlfunktionen von Integrinen sind darüber hinaus Ursachen sehr vieler Erkrankungen und daher für die Pharmaforschung von hohem Interesse.
Die Rolle der Erkennungssequenz
Von den 24 verschiedenen Integrinen des Menschen erkennen acht Subtypen eine kleine Sequenz aus nur drei Aminosäuren, nämlich Arginin, Glycin und Asparaginsäure (Kurzschreibweise: Arg-Gly-Asp, Einbuchstaben-Code: RGD).
Wie ein Schlüssel passt diese Struktur in den Rezeptor des Integrins. Signalmoleküle und Proteine mit dieser Sequenz lösen damit eine Reaktion der Zelle aus. Zusammen mit weiteren der Erkennung dienende Aminosäuren entscheidet die räumliche Struktur der Sequenz, zu welchem der Integrine der Schlüssel passt.
Die Arzneimittelforschung sucht nun Moleküle, die diese Erkennungssequenzen in der richtigen räumlichen Struktur besitzen und die gleichen Zellreaktionen auslösen können. Die Möglichkeit, verschiedene Integrin-Subtypen gezielt adressieren zu können, ist ein wichtiger Schritt in Richtung einer personalisierten Medizin, in der jede Krebsart patientenspezifisch bekämpft werden kann.
Publikationen:
Lösung des Problems mangelnder oraler Verfügbarkeit cyclischer Hexapeptide: Entwicklung eines selektiven, oral verfügbaren Liganden für das Integrin alpha-v-beta-3
Michael Weinmüller, Dr. Florian Rechenmacher, Dr. Udaya Kiran Marelli, Dr. Florian Reichart, Dr. Tobias G. Kapp, Dr. Andreas F. B. Räder, Dr. Francesco Saverio Di Leva, Prof. Dr. Luciana Marinelli, Prof. Dr. Ettore Novellino, Dr. José M. Muñoz-Félix, Prof. Dr. Kairbaan Hodivala-Dilke, Adi Schumacher, Dr. Joseph Fanous, Prof. Dr. Chaim Gilon, Prof. Dr. Amnon Hoffman und Prof. Dr. Horst Kessler
Angewandte Chemie, 18.12.2017, 129, 51, 16624-16629 – DOI: 10.1002/ange.201709709
https://doi.org/10.1002/ange.201709709
Improving oral bioavailability of cyclic peptides by N-methylation
Andreas F. B. Räder, Florian Reichart, Michael Weinmüller, Horst Kessler
Bioorganic & Medicinal Chemistry, 2017, in press
http://dx.doi.org/10.1016/j.bmc.2017.08.031
Exploring the Role of RGD-Recognizing Integrins in Cancer
Markus Nieberler, Ute Reuning, Florian Reichart, Johannes Notni, Hans-Jürgen Wester, Markus Schwaiger, Michael Weinmüller, Andreas Räder, Katja Steiger and Horst Kessler
Cancers 2017, 9, 116 – DOI: 10.3390/cancers9090116
http://www.mdpi.com/2072-6694/9/9/116
Kontakt:
Prof. Dr. Dr. h.c. Horst Kessler
Technische Universität München
Institute for Advanced Study
Lichtenbergstr. 2a, 85747 Garching, Germany
Tel.: +49-89 289 13300 – E-Mail: kessler@tum.de – Web: http://go.tum.de/106019
https://www.tum.de/die-tum/aktuelles/pressemitteilungen/detail/article/34503/ Link zur Pressemitteilung
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















