Computersimulation macht kurzlebige chemische Strukturen sichtbar
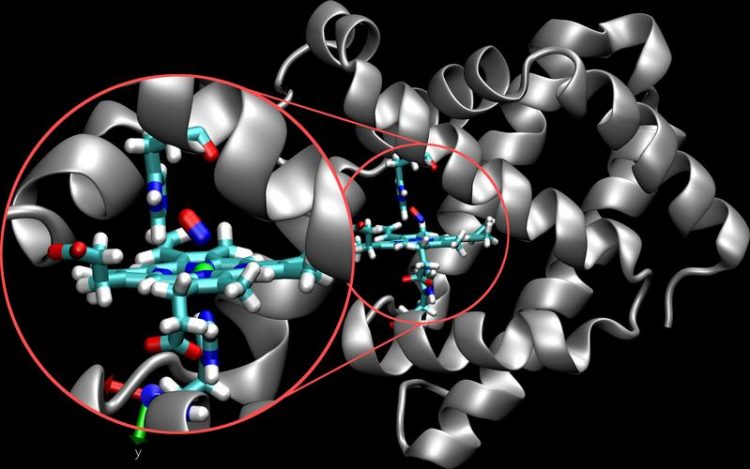
Die Struktur des Proteins Myoglobin (silber) mit dem eingebetteten aktiven Zentrum (farbig). Das Sickstoffmolekül (rot/blau) ist in dieser Abbildung an das Eisenatom (grüne Kugel) gebunden. Universität Basel, Departement Chemie
Mithilfe der computergestützten Chemie ist es möglich, die Bewegung einzelner Atome einer Verbindung zu charakterisieren. Modernste Simulationstechniken erlauben es heute, die Dynamik von Molekülen und Systemen mit hunderttausenden von Atomen quantitativ zu beschreiben.
Diese Techniken sind vor allem bei denjenigen Zuständen wichtig, die wegen ihrer kurzen Lebensdauer experimentell nur schwer direkt beobachtbar sind. Hier liefern Computersimulationen wertvolle, weiterführende Einsichten.
Die Funktion eines Eiweissmoleküls (Proteins) wird durch dessen Struktur und Dynamik bestimmt. Dabei ist von besonderer Bedeutung, dass man die für die Wirkungsweise relevanten Strukturen und molekularen Vorgänge im sogenannten aktiven Zentrum kennt – also an der Stelle, an der chemische Reaktionen stattfinden.
Das Bilden und Brechen chemischer Bindungen ist ein dynamischer Prozess und hat Strukturänderungen zur Folge. Die beobachtbare Dynamik endet in der Regel in stabilen (energiearmen) Zuständen, welche durch einen oder mehrere metastabile (energiereichere) Zwischenschritte erreicht werden. Ob sich ein metastabiler Zustand direkt experimentell nachweisen lässt oder nicht, hängt von dessen Lebensdauer ab. Ist diese zu kurz, stehen nur indirekte Nachweismethoden zur Verfügung.
Computer berechnet atomare Geometrie
Ein Forscherteam um Prof. Markus Meuwly vom Departement Chemie der Universität Basel hat nun mit sogenannt reaktiven Molekulardynamik-Simulationen das räumliche und zeitliche Verhalten des Proteins Myoglobin charakterisiert. Myoglobin ist für den Sauerstofftransport innerhalb der Zellen wichtig und kommt hauptsächlich im Muskelgewebe vor. Stickstoffmonoxid, das in den Zellen gebildet wird, ist ein kurzlebiger und reaktiver Botenstoff, der unter anderem eine wichtige Rolle bei der Erweiterung der Blutgefässe unter Sauerstoffmangel spielt.
«Zwar ist der Bindungsprozess von Stickstoffmonoxid an Myoglobin bereits gut experimentell untersucht, was für das Eichen von Computersimulationen wichtig ist», erklärt Prof. Meuwly. «Auch die Existenz von metastabilen Zwischenstufen konnte experimentell nachgewiesen werden. Aber nur mithilfe unserer Simulationen lassen sich die Strukturen solcher Zwischenstufen, ihre Dynamik und damit die Funktion des Proteins weitergehend entschlüsseln.»
Somit bilden Computersimulationen zusammen mit experimentellen Beobachtungen die Grundlage für das Verständnis komplexer chemischer und biologischer Systeme. Solch kombinierte Ansätze sind denn auch Ausgangspunkt für die Behandlung weitergehender Fragen, beispielsweise zur Anpassung und Optimierung von Proteinen oder pharmazeutischen Wirkstoffen. Dies setzt ein Verständnis der zugrunde liegenden Prozesse auf molekularer und atomarer Ebene voraus.
Originalartikel
Maksym Soloviov, Akshaya K. Das, Markus Meuwly
Structural Interpretation of Metastable States in MbNO
Angew. Chem. Int. Ed. (2016), doi: 10.1002/ange.201604552
Weitere Auskünfte
Prof. Dr. Markus Meuwly, Universität Basel, Departement Chemie, Tel. +41 61 267 38 21, E-Mail: m.meuwly@unibas.ch
Media Contact
Weitere Informationen:
http://www.unibas.chAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern-befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















