Chemotherapie: Weniger Nebenwirkungen und mehr Effizienz durch veränderte Immunzellen
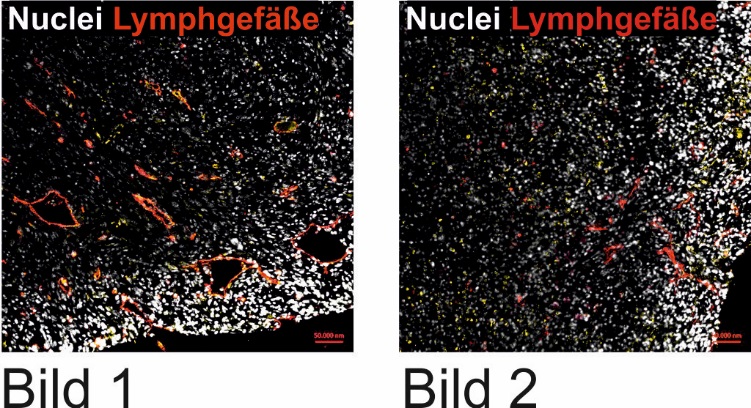
Links: Der Tumor ist mit Lymphgefäßen durchsetzt (rot). Rechts: Der Lipid-Rezeptor auf Makrophagen ist blockiert. Es gibt nur wenige Lymphgefäße, Tumorzellen können nicht wandern. Prof. B. Bruene, Universität Frankfurt
Eine Arbeitsgruppe an der Universität Frankfurt hat jetzt herausgefunden, wie Tumore es schaffen, Abwehrzellen des Immunsystems umzuprogrammieren und in ihre Dienste zu stellen.
Was genau dabei vor sich geht und wie Abwehrzellen gegen diesen Einfluss des Tumors gestärkt werden könnten, soll helfen, in Zukunft die Entwicklung gefährlicher Metastasen zu verhindern.
Die Erkenntnisse, die die Gruppe um Bernhard Brüne und Andreas Weigert jetzt schon erlangt hat, verbessern potentiell auch die Wirkung einer Chemotherapie.
Tumore bestehen aus entarteten, bösartigen Zellen, aber auch aus gesunden Zellen in ihrer unmittelbaren Umgebung. Hierzu zählen körpereigene Fresszellen, sogenannte Makrophagen. Sie gehören zur Immunabwehr und greifen Tumorzellen an, um sie mit Hilfe weiterer Immunzellen unschädlich zu machen. Diese natürliche Kontrolle dient dem Schutz des Körpers vor Tumorwachstum.
Doch Tumorzellen können dieser Kontrolle ausweichen: Sie erziehen Makrophagen durch molekulare Botschaften um, sodass diese das Tumorwachstum fördern anstatt es zu blockieren. Diese Strategie ist als Reprogrammierung oder Polarisierung von Makrophagen bekannt.
Dabei stellen Tumorzellen, die nach einem Angriff von Makrophagen sterben, mit ihrer Zerstörung eine fettähnliche Substanz her, das Lipid Sphingosin-1-Phosphat. Dieses Lipid dient als Überträger einer Programmierungsinformation und bindet an ein Zielmolekül auf den aktiven Makrophagen, wie ein Schlüssel in ein Schloss passt.
Krebszellen nutzen Tricks aus der Wundheilung
Das Andocken des Lipids löst Veränderungen in der Fresszelle aus: Die Zelloberfläche des Abwehrkörpers wird verändert, bildlich gesprochen öffnet der Schlüssel ein Haus, das anschließend umgebaut wird. So bekommt die Fassade – die Zelloberfläche – ein anderes Aussehen, die Innenbereiche erhalten andere Funktionen.
Danach verhält sich die Fresszelle völlig anders als von Natur aus vorgesehen: Sie fördert nun das Tumorwachstum. Diese Strategie der Umerziehung ihrer natürlichen Feinde sichert der Tumorzelle das Überleben: Sie kann weiter wachsen und auch Metastasen bilden.
Wie es scheint, handelt es sich bei diesem Trick der Krebszellen um einen sehr urtümlichen Mechanismus, der in der Evolution eigentlich für die Heilung und Regeneration von verletztem Gewebe genutzt wird. Die Krebszellen missbrauchen also eine Technik, die für die Heilung von Wunden gedacht ist. Deshalb bezeichnet man Tumore auch als Wunden, die nicht heilen.
Wie Tumorzellen im Körper wandern
Was genau zwischen Fresszellen und von sterbenden Tumorzellen produzierten Lipiden vor sich geht, haben die Frankfurter Forscher um Bernhard Brüne und Andreas Weigert jetzt aufgeklärt. Dabei konnten sie auch zeigen, dass die Umprogrammierung von Makrophagen vor allem die Ansiedelung von Tochtertumoren an anderen Stellen im Körper ermöglicht.
Der Lipidrezeptor auf Makrophagen spielt hierbei eine wichtige Rolle für den Anschluss an das Blut- und Lymphsystem. Über Lymph- und Blutbahnen wandern einzelne Krebszellen in weit entfernt liegende Organe, wachsen dort an und werden zu den gefürchteten Metastasen.
Zuvor helfen ihnen dabei die vom Ausgangstumor umprogrammierten Makrophagen. Diese schütten nach ihrer Veränderung neue Signalsubstanzen, sogenannte Zytokine, aus. So schließen sie den Primärtumor an das Lymphsystem an, so dass von dort Krebszellen in die Lymphbahnen einwandern können.
Metastasen verhindert
Die Frankfurter Forscher wollen ihre Erkenntnisse jetzt für die Entwicklung neuer Tumortherapien nutzen. Sie haben in Experimenten sowohl auf Zellen im Labor als auch bei Mäusen den Lipid-Rezeptor auf der Oberfläche von Makrophagen blockiert. Wie sich zeigte, konnte der Tumor danach nicht an das Lymphsystem angeschlossen werden. Das verhinderte die Verteilung von Tumorzellen im Körper und deren Ansiedelung in der Lunge.
Auch Chemotherapie-Studien bei Mäusen, die Krebsgeschwüre hatten, wurden bereits durchgeführt. Diesen Mäusen fehlte der Lipidrezeptor auf Makrophagen. Die Wissenschaftler fanden dabei heraus, dass der Lipidrezeptor grundsätzlich nötig ist, damit die Fresszellen überhaupt ihrer ursprünglichen Aufgabe nachkommen und gegen Tumorzellen vorgehen.
Schneller Nutzen für die Patienten
Weitere Experimente sollen nun zeigen, wie sich Makrophagen bei Chemotherapie verhalten. Eine Chemotherapie hat nach wie vor starke Nebenwirkungen und belastet die Patienten sehr. Daher ist es wichtig, ihre Wirksamkeit zu verbessern und die Behandlungsdauer zu verkürzen.
Das könnte mit Hilfe von Fresszellen gelingen, die durch Chemotherapie so aktiviert werden, dass sie den Kampf gegen Tumore wieder aufnehmen.
Ein anderer Weg wäre die Veränderung der Rezeptoren bei Fresszellen, die bereits neu programmiert wurden. „Wir wollen im nächsten Schritt auch versuchen, die Lipid-Rezeptoren auf Makrophagen so zu verändern, dass die Botschaften der Krebszellen gar nicht erst ankommen“, so Bernhard Brüne. „Das würde die Chemotherapie effizienter machen“.
„Auf jeden Fall sind wir sicher, setzt der Leiter der Arbeitsgruppe fort, „dass die Rolle von Makrophagen in der Umgebung von Tumorzellen für das Verständnis von Tumorbildung und –wachstum große Bedeutung für zukünftige Therapieentwicklungen hat.“
Das Frankfurter Team bemüht sich jetzt darum, seine Forschungsergebnisse schnell für die konkrete Behandlung von Patienten nutzbar zu machen. Dies könnte in Zukunft in Kombination mit Chemotherapie der Fall sein.
Die Wilhelm Sander-Stiftung hat dieses Forschungsprojekt mit rund 187.000 Euro unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 220 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz bewilligt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen bayerischen bayerischen Unternehmers hervor, der 1973 verstorben ist.
Originaltitel des Forschungsprojekts:
Die Hemmung oder Elimination des Sphingosin-1-Phosphat-Rezeptors 1 auf Tumor-assoziierten Makrophagen verbessert die Tumortherapie bei Einsatz von Chemotherapeutika.
Kontakt
Prof. Dr. Bernhard Brüne und PD Dr. Andreas Weigert
Goethe-Universität Frankfurt
Fakultät für Medizin
Biochemie I (Pathobiochemie)
Theodor-Stern-Kai 7
60590 Frankfurt am Main
http://www.pathobiochemie1.de/
Sekretariat: Simone Graf
Tel.: (+49) 69 – 6301 7423
officebc1@biochem.uni-frankfurt.de
Kontakt Wilhelm Sander-Stiftung
Wilhelm Sander-Stiftung
Goethestraße 74
80336 München
Tel: +49 (89) 544 187 0
Fax: +49 (89) 544 187 20
Web: www.sanst.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…





















