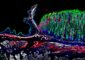
Cell: Proteine verbinden sich wie ein Reißverschluss

Wie die Zähne eines Reißverschlusses schmiegen sich die geladenen Aminosäuren (rot, blau) aneinander und verbinden so die Proteine.<br>Bild: KIT<br>
Dabei spielt ihre Form, also die Faltung der Moleküle, eine entscheidende Rolle, um etwa Poren zu bilden. Forscher des Karlsruher Institutes für Technologie und der Universität Cagliari stellen nun im Fachmagazin Cell vor, wie sich die Proteine dabei eines neuartigen Reißverschlussprinzips bedienen, um Funktionseinheiten zu schaffen.
(DOI: 10.1016/j.cell.2012.12.017)
„Es ist faszinierend zu sehen, welch elegante Grundprinzipen die Natur beim Bau von molekularen Maschinen verwendet“, erklärt Anne Ulrich, Direktorin am Institut für Biologische Grenzflächen des KIT. „Ein ‚Ladungsreißverschluss‘ zwischen geladenen Seitenketten ist ein ganz unerwarteter Mechanismus, wie Membranproteine ihre Ladungen neutralisieren und auf diese Weise hydrophobe Zellmembranen durchspannen können.“
In der aktuellen Studie untersuchen Ulrich und ihr Team die Twin-Arginine Translocase (Tat), die in der Zellmembran von Bakterien als Export-Maschinerie für gefaltete Proteine dient. Mehrere Exemplare des Bausteins TatA lagern sich zu einer Pore zusammen und können dabei den Durchmesser der Pore flexibel an die zu transportierende Fracht anpassen. „Doch wie baut man eine Pore aus TatA-Proteinen? Wie können sie reversibel ein riesiges Loch in der Membran ausbilden, um den unterschiedlichsten Molekülen den Weg freizumachen, aber ohne dass die Zelle dabei leckschlägt?“, formuliert Ulrich die Ausgangsfragen.
Um das zu klären, haben die Forscher den molekularen Aufbau von TatA im Bakterium B. subtilis untersucht, das aus einer Kette von 70 Aminosäuren besteht. Die Strukturanalyse hat gezeigt, dass sie sich zu einer starren, stäbchenförmigen Helix auffaltet, auf die ein sehr geschmeidiger, langgestreckter Bereich folgt. Viele der Aminosäuren in der Helix und im angrenzenden Bereich tragen negative oder positive Ladungen, die einer Ionenladung entsprechen. „Erstaunlicherweise ist die Reihenfolge der Ladungen auf der Helix komplementär zu denen im angrenzenden Bereich des Proteins. Klappt man das Protein also an der Verbindungsstelle zusammen wie ein Scharnier, treffen immer positive und negative Ladungen aufeinander und ziehen sich an. Das Protein verbindet also seine beiden Bereiche so, wie die Zähne eines Reißverschlusses ineinandergreifen.
„Der Clou ist jedoch, dass dieses Bindungsprinzip auch gegenüber den Nachbarproteinen funktioniert“, erklärt Ulrich. Statt sich also ganz alleine zuzuklappen, geht jedes TatA Protein auch Reißverschlussbindungen mit seinen beiden Nachbarn ein. Wie Computersimulationen zeigen, entstehen dadurch stabile und zugleich flexible Verbindungen zwischen den benachbarten Molekülen. So können sich auf diese Weise beliebig viele Proteine zu einem insgesamt ungeladenen Ring zusammen lagern, der dann die TatA Pore in der hydrophoben Membran auskleidet. Dieses neuartige Reißverschlussprinzip scheint nicht nur beim Proteintransport eine Rolle zu spielen, sondern auch beim Angriff bestimmter antimikrobieller Peptide auf Bakterien, oder bei deren Stressantwort durch Biofilmbildung.
Weitere Informationen zur Arbeitsgruppe:
http://www.ibg.kit.edu/nmr/
Das Karlsruher Institut für Technologie (KIT) ist eine Körperschaft des öffentlichen Rechts nach den Gesetzen des Landes Baden-Württemberg. Es nimmt sowohl die Mission einer Universität als auch die Mission eines nationalen Forschungszentrums in der Helmholtz-Gemeinschaft wahr. Das KIT verfolgt seine Aufgaben im Wissensdreieck Forschung – Lehre – Innovation.
Weiterer Kontakt:
Kosta Schinarakis
PKM – Themenscout
Tel.: +49 721 608 41956
Fax: +49 721 608 43658
E-Mail:schinarakis@kit.edu
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue Industrie-4.0-Lösung für niedrigschwelligen Zugang zu Datenräumen
»Energizing a Sustainable Industry« – das Motto der Hannover Messe 2024 zeigt klar, wie wichtig eine gleichermaßen leistungsstarke und nachhaltige Industrie für den Fertigungsstandort Deutschland ist. Auf der Weltleitmesse der…

Quantenpräzision: Eine neue Art von Widerstand
Physikforschende der Universität Würzburg haben eine Methode entwickelt, die die Leistung von Quantenwiderstands-Normalen verbessern kann. Sie basiert auf einem Quantenphänomen namens anomaler Quanten-Hall-Effekt. In der industriellen Produktion oder in der…

Sicherheitslücke in Browser-Schnittstelle erlaubt Rechnerzugriff über Grafikkarte
Forschende der TU Graz waren über die Browser-Schnittstelle WebGPU mit drei verschiedenen Seitenkanal-Angriffen auf Grafikkarten erfolgreich. Die Angriffe gingen schnell genug, um bei normalem Surfverhalten zu gelingen. Moderne Websites stellen…