Geschickt verpackt
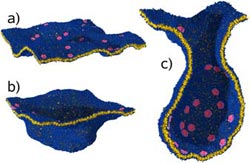
Abb. 1: Die Simulation der Max-Planck-Forscher zeigt, wie sich auf einer Membran großflächige Einstülpungen bilden: Auf einer Membran (blau-gelb) haften Proteine (rot), welche die Membran lokal krümmen (a), dies führt zu einer Ausbuchtung (b). In (c) ist ein fast abgeschnürtes Vesikel im Querschnitt zu sehen. Bild: Max-Planck-Institut für Polymerforschung
Auf die Verpackung kommt es an: Auch Zellen schließen Proteine zum Transport in kleine Membranbläschen ein, damit sich diese unterwegs nicht mit anderen Substanzen vermischen. Wie diese Bläschen, die Vesikel, genau gebildet werden, zählt zu den wichtigen Fragen der Zellbiologie. Forscher des Mainzer Max-Planck-Instituts für Polymerforschung haben mittels einer Computersimulation herausgefunden, wie bestimmte Proteine ohne direkte Wechselwirkung untereinander großflächige Ausstülpungen der Membran erzeugen. Der physikalische Mechanismus, den die Wissenschaftler mit ihrer Simulation entdeckten, wirkt möglicherweise auch an anderen Prozessen mit, bei denen Zellmembranen verformt werden. So ließe sich damit etwa die Bildung von Organellen mit stark gekrümmten Oberflächen wie dem Golgi-Apparat und den Mitochondrien beschreiben (Nature, 24. Mai 2007).
Jede Zelle des menschlichen Körpers ähnelt einer Fabrik auf kleinstem Raum, die unermüdlich tausende Substanzen produziert. Unter anderem müssen Botenstoffe und Zellbausteine synthetisiert und an die richtige Stelle transportiert werden. Für diesen Materialaustausch verfügen Zellen über einen raffinierte Verpackungsmechanismus: Fertige Proteine werden in kleine Bläschen eingeschlossen, die sich aus der Zellmembran abschnüren. Dazu lagern sich spezielle Proteine an der Membranwand an. Diese verformen die Membran – eine Einstülpung entsteht. Im Inneren eines solchen Vesikels eingeschlossene Proteine überstehen den Transport durch die Zelle, ohne sich unterwegs mit anderen Substanzen zu vermischen. Während Zellbiologen die für die Verformung zuständigen Proteine schon seit längerem kennen, wussten sie über den Prozess der Vesikelbildung bisher noch sehr wenig.
Mit einer Computersimulation haben Wissenschaftler um Markus Deserno am Max-Planck-Institut für Polymerforschung in Mainz nun gezeigt, wie Proteine bei der Verformung der Membran zusammenarbeiten: Binden sie an die Membranoberfläche, rufen sie in ihrer unmittelbaren Umgebung eine trichterähnliche Verformung hervor. Ohne direkt miteinander zu wechselwirken, beeinflussen sich die membrangebundenen Proteine indirekt über die Verformung der Membran. Sobald sich zwei Proteine zu nahe kommen und die gekrümmten Membranen überlappen, führt das zu einer Anziehung, aus der bei ausreichend vielen Proteinen eine Membraneinstülpung entsteht. Diese Anordnung der Proteine ähnelt der von zwei nah beieinander liegenden Kugeln auf einem gespannten Gummituch.
„Uns geht es dabei grundsätzlich um die Frage, wie Membranen verformt werden“, sagt Markus Deserno. „In der Zelle gibt es zahlreiche Organellen, etwa den Golgi-Apparat oder die Mitochondrien, deren Membranoberflächen auf ganz bestimmte Art und Weise gekrümmt sind. Solche Verformungen kosten viel Energie, und das muss die Zelle irgendwie steuern. Möglicherweise spielen die Mechanismen, die wir entdeckt haben, auch dort eine Rolle.“
Zu Beginn der Simulation sind die membrankrümmenden Proteine erst einmal gleichmäßig verteilt. Im Verlauf der Vesikelbildung wandern sie auf der Membran und häufen sich an bestimmten Stellen. „Das ist das einfachste Szenario, von dem wir ausgehen können“, sagt Deserno. „Vermutlich macht die Natur das schlauer und bringt Proteine von Anfang gehäuft an bestimmte Stellen.“ Außerdem mussten die Max-Planck-Forscher auf die Modellierung von einzelnen Atomen verzichten, sonst wäre das Experiment im Computer rechnerisch nicht zu bewältigen gewesen. Denn während die Natur eine Vesikel in wenigen Millisekunden bildet, benötigten die Computercluster des DEISA-Projektes (Distributed European Infrastructure for Supercomputing Applications) dafür mehrere Wochen.
Originalveröffentlichung:
Benedict J. Reynwar, Gregoria Illya, Vagelis A. Harmandaris, Martin M. Müller, Kurt Kremer und Markus Deserno
Aggregation and Vesiculation of membrane proteins by curvature mediated interactionsAggregation and Vesiculation of membrane proteins by curvature mediated interactions. Nature, 24. Mai 2007
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















