Verkehrsregeln für den Kerntransport

Dortmunder Max-Planck-Wissenschaftler entschlüsseln wichtige Protein-Transportfähre für den „Rangierbetrieb“ durch die Membran des Zellkerns
Eine wichtige Voraussetzung für das Leben von Eukaryonten ist ein unaufhörlicher und kontrollierter Stoffaustausch zwischen dem Zellkern und dem umgebenden Zellplasma (Zytoplasma). Der Nukleus einer Säugerzelle enthält etwa 4000 Kernporen, durch die jeweils etwa 400 Moleküle pro Sekunde transportiert werden. Wissenschaftler vom Max-Planck-Institut für molekulare Physiologie in Dortmund haben jetzt die Struktur eines für diesen Kerntransport zentralen Molekülkomplexes aufgeklärt. Dieser besteht aus den drei Proteinen Ran, RanBP1 und RanGAP und ist zugleich Anfangs- und Schlusspunkt des so genannten nukleozytoplasmatischen Transportzyklus. Die Forschungsergebnisse tragen wesentlich zum Verständnis dieses für alle Lebensvorgänge wichtigen Transportvorgangs bei und liefern neue Erkenntnisse über die GTP-Hydrolyse durch Guanin-Nukleotid bindende Proteine (GNBPs), die eine wichtige Rolle bei der Signalübertragung in Zellen spielen.
Die Zellen von Eukaryonten unterscheiden sich von einfachen Bakterienzellen durch ihre Unterteilung in Kompartimente. Diese ermöglichen es, Lebensvorgänge geordnet und effizient in der Zelle ablaufen zu lassen. Im Zellkern, dem Steuerungszentrum der Zelle, befindet sich die chromosomale DNA, deren Information als „messenger RNA“ (mRNA) kopiert und in das Zytoplasma zur Übersetzung durch die Ribosomen transportiert wird. Neben diesem Export aus dem Zellkern ist aber auch die umgekehrte Transportrichtung, der Import von Signalmolekülen aus dem Zellplasma in den Zellkern von Bedeutung. Damit die für den Zellkern und/oder das Zytoplasma bestimmten Proteine auch ihren Bestimmungsort erreichen, tragen sie ein Erkennungssignal, das wie eine Postleitzahl oder Adresse funktioniert und von der Transportmaschinerie als solches erkannt wird.
Insgesamt sind ca. 100 bis 200 verschiedene Proteine am kontrollierten Ablauf von Kernexport und -import beteiligt. Allein 30 bis 40 Proteine werden für die Bildung der Kernporen gebraucht, die die Kernmembran durchspannen und den Transportkanal für den Import und Export von Molekülen darstellen. Während Proteine unterhalb einer bestimmten Größe (etwa 50.000 Dalton) frei zwischen Zytoplasma und Zellkern hin und her diffundieren können, benötigen größere Makromoleküle die Mithilfe so genannter Rezeptorproteine, die die zu befördernde Ladung erkennen und durch die Kernporen schleusen.
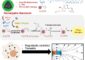
Sowohl der Import wie der Export verläuft durch ein und dieselbe Kernpore. Das ist möglich, da ein Guaninnukleotid-bindendes Protein (GNBP) namens Ran – je nachdem, in welchem Zell-Kompartiment es sich gerade befindet – in einem von zwei Zuständen vorliegt. Ran ist gewissermaßen ein molekularer Schalter, der indirekt die für den Transport benötigte Energie liefert. Im Kerninneren sorgt das Protein RanGEF (GEF, guanine nucleotide exchange factor) dafür, dass Guanosin-Triphosphat (GTP) an Ran gebunden wird (siehe Abb. 1a). Gelangt Ran*GTP aus dem Zellkern hinaus in das Zytoplasma, wird es dort vom Gegenspieler des RanGEF, dem so genannten GTPase-aktivierenden Protein (GAP), gebunden. Die Folge dieser Reaktion ist enorm: In wenigen Sekunden wird das gebundene GTP zu GDP hydrolysiert, d.h. durch die Reaktion mit Wasser umgewandelt. Im Ergebnis liegt Ran dann in seinem zweiten Zustand vor – als Ran*GDP.
 |
|
|
„Abb. 1: Ran-abhängiger Kerntransport. a) Kerntransportzyklus; b) Proteinkomplex aus Ran*GppNHp, RanBP1 und RanGAP“ „Grafik: Max-Planck-Institut für molekulare Physiologie“ |
Ohne äußere Einflüsse wechselt Ran nur sehr langsam zwischen den beiden Zuständen. Erst wenn weitere aktivierende Proteine hinzukommen, beschleunigt sich dieser Prozess. Die Dortmunder Wissenschaftler konzentrierten sich deshalb bei ihren Forschungen auf die Interaktionen von Ran mit dem Aktivator-Protein RanGAP und dem noch hinzukommenden Protein RanBP1. Um auf molekularer Ebene das Wechselspiel der Proteine zu beobachten, nutzten die Forscher die Röntgenstrukturanalyse. Hierbei ging es vor allem um folgende Fragen: Wie gelingt es dem GAP, den Abbau von GTP um das 100.000fache zu beschleunigen? Welche Rolle spielt dabei das Protein RanBP1, von dem zuvor schon bekannt war, dass es eine feste Verbindung mit Ran in der GTP-Form eingeht? Und schließlich die wohl schwierigste Frage: Nach welchem Mechanismus wird das GTP tatsächlich hydrolysiert?
Um die Proteine für die Röntgenstrukturanalyse kristallisieren zu können, mussten die Forscher zunächst in die chemische Trickkiste greifen. Denn die Bindung von Ran*GTP an GAP ist nur kurzlebig, so dass dieser Proteinkomplex nicht ohne weiteres kristallisiert werden kann. Erst als die Wissenschaftler an Stelle des Guanosin-triphosphates nicht-hydrolysierbare Analoga eingesetzt haben, blieb der Proteinkomplex über Tage stabil und erlaubte eine Kristallisation. Eines dieser Analoga ist GppNHp; es enthält eine schwer spaltbare NH-Funktion als Brücke zwischen γ-Phosphat und β-Phosphat.
Die Beobachtung des Proteinkomplexes zeigte, dass das GAP ein in Ran schon weitgehend vorhandenes enzymatisches Zentrum komplementiert. Überraschend war, daß Ran und RanBP1 völlig unabhängig von RanGAP miteinander interagieren (siehe Abb. 1b). Offenbar fördert RanBP1 die Interaktion zwischen Ran und RanGAP ohne direkten Kontakt mit dem GAP. Die Aminosäuresequenz von RanGAP zeigt zwei Besonderheiten: An einem Ende – dem N-Terminus – befinden sich so genannte Leucin-reiche Wiederholungen (LRRs, leucine rich repeats), am entgegengesetzten, C-terminalen Ende findet sich eine Häufung von sauren Aminosäuren (Aspartat, Glutamat). Während der N-terminale Bereich in alternierenden Segmenten als α-Helix und als β-Faltblatt strukturiert ist, zeigt der zweite Bereich keine definierte Struktur. Im Proteinkristall konnte das saure Ende des RanGAP nicht lokalisiert werden. Das war überraschend, da dieser Teil eigentlich für die hohe Bindungsstärke zwischen Ran und GAP mitverantwortlich ist.
Doch die Forscher hatten auch ein großes Interesse daran zu verstehen, wie die GTP-Hydrolyse selbst funktioniert. Es wurde in der Fachliteratur heftig darüber diskutiert, ob es bei der Reaktion kurzzeitig zu einer Vermehrung negativer Ladungen in der Umgebung des g-Phosphoratoms kommt. Dann müssten diese Ladungen stabilisiert werden, indem GAP selbst eine positive Ladung in die Nähe bringt. In der Vergangenheit hatte man dafür bereits Belege gefunden. So stellte man bei den bisher untersuchten GNBP*GAP-Komplexen fest, dass das GAP in der Tat eine positiv geladene Aminosäure in das aktive Zentrum des GNBP einfügt, einen so genannten Arginin-Finger.
Deshalb gingen die Dortmunder Forscher davon aus, auch in dem Komplex aus Ran, RanBP1 und RanGAP einen Arginin-Finger beobachtet zu können. Doch auch in dieser Hinsicht hat sie der Proteinkomplex überrascht – in der Nähe des enzymatisch aktiven Zentrums konnten sie kein essentielles Arginin identifizieren, das in die Rolle eines solchen Fingers schlüpfen könnte (Abb. 2). Folglich muss für Ran dieser Mechanismus neu überdacht werden. Vermutlich war die Idee des positiv geladenen Arginin-Fingers zu einfach. Wir müssen bei der Frage, was die Hydrolyse beeinflussen könnte, andere Aminosäuren im aktiven Zentrum mit in Betracht ziehen. Elektrostatische Ladungsverteilungen können entscheidend sein. Allein die stereochemisch korrekte Ausrichtung des „angreifenden“ Wassermoleküls durch eine besonders essentielle Aminosäure Glutamin, sowie der Ausschluss weiterer Wassermoleküle aus dem aktiven Zentrum könnten ausreichen, die beobachteten Effekte zu erklären.
 |
|
|
„Abb. 2: Elektronendichtekarte der Proteinstruktur mit GDP*AlFx Analogon (3.1 Å Auflösung; Kontur bei 1.6 ) “ „Foto: Max-Planck-Institut für molekulare Physiologie“ |
Die erreichten Forschungsergebnisse liefern für das allgemeine Verständnis der Guaninnukleotid-bindenden Proteine (GNBP) weiterhin Diskussionsstoff. Zum einen ist der Ran-kontrollierte Kerntransport extrem lebenswichtig – selbst kleinste Veränderungen führen zum sofortigen Tode der Zelle. Zum anderen werden bestimmte Mitglieder der GNBP-Familie mit den verschiedensten Krankheitsbildern in Verbindung gebracht. Das prominenteste Beispiel ist das Ras-Protein: Es wird in 50% aller Darmtumoren und ca. 90% aller Bauchspeicheltumoren, d.h. einem Drittel aller menschlichen Krebserkrankungen, in veränderter Form gefunden. Für das Verständnis der Funktionsweise dieses Proteins sind auch die für das Ran-Protein gewonnenen Informationen relevant und können zu einem besseren Verständnis der Krebsentstehung und einer effizienteren Wirkstoffsuche beitragen.
Originalarbeit: Michael J. Seewald, Carolin Körner, Alfred Wittinghofer und Ingrid R. Vetter: RanGAP mediates GTP hydrolysis without an arginine finger, Nature, 7. Februar 2002
Media Contact
Weitere Informationen:
http://www.mpg.de/doku/jahrbuch/2001/jahrbuch2001_329_339.pdfAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Erstmals 6G-Mobilfunk in Alpen getestet
Forschende der Universität Stuttgart erzielen leistungsstärkste Verbindung. Notrufe selbst in entlegenen Gegenden absetzen und dabei hohe Datenmengen in Echtzeit übertragen? Das soll möglich werden mit der sechsten Mobilfunkgeneration – kurz…

Neues Sensornetzwerk registriert ungewöhnliches Schwarmbeben im Vogtland
Das soeben fertig installierte Überwachungsnetz aus seismischen Sensoren in Bohrlöchern zeichnete Tausende Erdbebensignale auf – ein einzigartiger Datensatz zur Erforschung der Ursache von Schwarmbeben. Seit dem 20. März registriert ein…

Bestandsmanagement optimieren
Crateflow ermöglicht präzise KI-basierte Nachfrageprognosen. Eine zentrale Herausforderung für Unternehmen liegt darin, Über- und Unterbestände zu kontrollieren und Lieferketten störungsresistent zu gestalten. Dabei helfen Nachfrage-Prognosen, die Faktoren wie Lagerbestände, Bestellmengen,…