Molekulare Zahnrädchen für die Signalübertragung
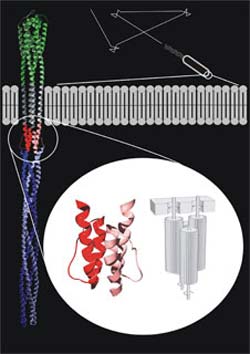
Die HAMP-Domäne (rot) kann durch Rotation der vier Helices ihre Konformation ändern. Die Bewegung der Helices erinnert an die Rotation von vier Zahnrädern in einem Getriebe, da die Seitenketten im Inneren ineinander greifen. Die HAMP-Domäne ist ein Teil der modular aufgebauten Rezeptorproteine, die in Zellmembranen von Bakterien vorkommen (die einzelnen Module sind in grün, grau, rot und blau dargestellt). In der Abbildung ist ein Rezeptor für die Chemotaxis gezeigt, der das Bewegungsverhalten der Bakterien beeinflusst (oben rechts). Bild: Max-Planck-Institut für Entwicklungsbiologie, Tübingen
Damit Bakterienzellen ihre Umgebung wahrnehmen und auf sie reagieren können, müssen sie Informationen über ihre Umgebung in die Zelle weiterleiten. Viele Rezeptorproteine sind bereits bekannt und über den molekularen Mechanismus der Signalübertragung wurde viel spekuliert. Wissenschaftlern vom Max-Planck-Institut für Entwicklungsbiologie in Tübingen und vom Institut für Pharmazie der Universität Tübingen ist es nun gelungen, die Struktur der HAMP-Domäne zu entschlüsseln (Cell, 8.September 2006). Dabei handelt es sich um einen Teilbereich eines Rezeptorproteins, der die extrazelluläre mit der intrazellulären Domäne verbindet und daher eine entscheidende Rolle bei der Signalweiterleitung spielt. Die Struktur offenbart die Fähigkeit der HAMP-Domäne, zwischen zwei Konformationen hin und her zu wechseln. Die Forscher erklären diesen Konformationswechsel mit einer Bewegung, die an die Rotation von vier ineinander greifenden Zahnrädern erinnert.
Bakterien haben eine Vielzahl sensorischer Systeme entwickelt, um ihre Umwelt wahrzunehmen und darauf zu reagieren. Oft spüren sie damit günstigere, zum Beispiel nährstoffreichere, Umgebungen auf und bewegen sich aktiv darauf zu. Das gezielte Wandern entlang eines chemischen Konzentrationsgradienten bezeichnet man als Chemotaxis. Dabei löst ein Reiz der Umgebung eine vorprogrammierte Verhaltensweise aus. Wie kann man sich Chemotaxis als Reaktion auf einen solchen chemischen Stimulus vorstellen?
Normalerweise zeigen Bakterien ein Bewegungsverhalten, das aus Schwimm- und Taumelbewegungen besteht und die Zelle um ihren momentanen Aufenthaltsort herum torkeln lässt. Gerät die Bakterienzelle in einen Konzentrationsgradienten eines attraktiven Stoffes (z.B. Zucker) und ist in dessen Richtung ausgerichtet, so wird ein Schalter in der Zelle umgelegt: Um dem Gradienten folgen zu können, wird die Schwimmbewegung zeitlich verlängert. Besteht der Gradient weiter, so folgt nach einer kurzen Neuorientierung eine erneute, verlängerte Schwimmbewegung.
Die entsprechenden Schalter befinden sich in der Zellmembran hauptsächlich an den Zellpolen. Dabei handelt es sich um Proteine, die einen in den Außenraum ragenden extrazellulären Teil besitzen, mit dem sie äußere Reize aufnehmen, und einen intrazellulären Teil, der das Signal für die Bewegungsänderung in die Zelle weiterleitet. Diese Rezeptoren bestehen aus verschiedenen Modulen, sodass viele externe Stimuli mit einer Vielzahl von internen Antwortmöglichkeiten kombiniert werden können.
Die Wissenschaftler vom Max-Planck-Institut für Entwicklungsbiologie in Tübingen wollten nun genau wissen, wie Informationen von Außen ins Zellinnere gelangen. Im Fall der Chemotaxis führt die Bindung eines Signalmoleküls an den extrazellulären Teil eines Rezeptors zur Auslösung einer ganzen intrazellulären Reaktionskaskade. An ihrem Ende steht die Phosphorylierung bestimmter Proteine, die den Bewegungsapparat des Bakteriums beeinflussen.
Da der Rezeptor keinen Transport von Signalmolekülen in die Zelle vermittelt, kann das Signal nur auf mechanischem Wege weitergegeben werden, das heißt, es muss zu einer Konformationsänderung im Rezeptor kommen – das wäre die einzig denkbare Möglichkeit der Informationsübertragung von Außen nach Innen. Verschiedene Konformationsänderungen wurden bereits für solche Rezeptoren diskutiert. Aber die Wissenschaftler tappten weitgehend im Dunkeln, da die molekulare Struktur des Moduls unbekannt war, das den extrazellulären mit dem intrazellulären Teil verbindet. Dieses Modul wird HAMP-Domäne genannt.
Andrei Lupas und seine Mitarbeiter konnten nun die Struktur einer HAMP-Domäne mittels NMR-Spektroskopie aufklären. Sie wählten dafür eine HAMP-Domäne aus dem Archaebakterium Archaeoglobus fulgidus, das in heißen Quellen von etwa 100°C lebt. Der Vorteil: Das Protein dieses hyperthermophilen Organismus war bei Raumtemperatur starr und daher für NMR-Untersuchungen geeignet. Bisherige Strukturuntersuchungen waren wohl daran gescheitert, dass die HAMP-Domäne unter Untersuchungsbedingungen rasch zwischen zwei Schalterpositionen hin und her wechselte.
Die Strukturuntersuchungen offenbarten, dass es sich bei der HAMP-Domäne um ein Bündel aus zwei mal zwei parallelen alpha-Helices handelt. Dabei entdeckten die Wissenschaftler eine völlig neuartige, geometrische Anordnung der Seitenketten im Inneren der Helixbündel. Interessanterweise konnte diese Seitenkettengeometrie in Computermodellen durch zahnradartige Drehung der einzelnen Helices in die allgemein bekannte Geometrie überführt werden.
„Wir haben nun vermutet, dass beide Geometrien, das heißt beide Konformationen, je einen Signalzustand repräsentieren und die zahnradartige Helixrotation die gesuchte, mechanische Konformationsänderung zur Signalübertragung darstellt“, erklärt Michael Hulko. Durch gezielte Mutationen einzelner Aminosäurereste und mit Unterstützung von Wissenschaftlern aus der Arbeitsgruppe von Joachim Schultz von der Universität Tübingen konnten die Forscher dann zeigen, dass sich die HAMP-Domäne tatsächlich in einen anderen Signalzustand versetzen lässt, wenn man versucht, die herkömmliche Konformation gegenüber der neuartigen zu stabilisieren.
Noch fehlt die Strukturaufklärung der zweiten Schalterstellung, auf deren Existenz alle bisherigen Hinweise deuten. Auch möchten die Wissenschaftler gerne wissen, durch welche Eigenschaften die einzelnen Schalterstellungen stabilisiert werden und wie sich die Leichtigkeit des Umschaltens modulieren lässt. Dieser in Bakterien gefundene Zahnradmechanismus könnte – so ihre Spekulation – auch eine universelle Bedeutung haben.
Originalveröffentlichung:
Michael Hulko, Franziska Berndt, Markus Gruber, Jürgen U. Linder, Vincent Truffault, Anita Schultz, Jörg Martin, Joachim E. Schultz, Andrei Lupas, Murray Coles
The HAMP domain structure implies helix rotation in transmembrane signaling
Cell, 8. September 2006
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















