Molekulares Recycling von Transportbehältern
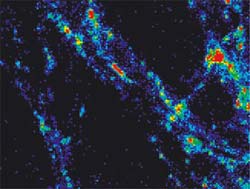
Aktive Synapsen, sichtbar gemacht mit einer neuen molekularen Sonde. Sind die Synapsen aktiv, leuchten sie auf. Ist ihre Aufgabe erledigt, gehen auch die Lichter aus. Auf diese Weise konnten Forscher des Max-Planck-Instituts für biophysikalische Chemie den Synapsen "beim Sprechen" zusehen und die Frage klären, wie und wie schnell die Proteine eines synaptischen Vesikels recycelt werden. Bild: Max-Planck-Institut für biophysikalische Chemie
Nervenzellen reden miteinander, indem winzige mit Botenstoffen gefüllte Bläschen (Vesikel) an den Kontaktstellen zu Nachbarzellen, den Synapsen, mit der Zellmembran verschmelzen, chemische Botenstoffe freisetzen und so den Nervenimpuls weiterleiten. Doch auf welche Weise die hierbei gestrandeten „Exportbehälter“ später wieder verwendet werden, war bisher nicht klar. Mit Hilfe einer neu entwickelten Sonde haben jetzt Forscher des Max-Planck-Instituts für biophysikalische Chemie in Göttingen den Synapsen live „beim Sprechen“ zugeschaut. Zu ihrer Überraschung und anders, als bisher angenommen, werden die für die Recyclierung bestimmten Behälter aus Proteinen früherer Export-Behälter zusammengebaut, die bereits als Pool in der Zellmembran gelagert sind. Das erklärt, warum Signalübertragung und Denkprozesse so schnell sein können (Nature Neuroscience, Advanced Online-Publikation, 16. Juli 2006).
Stellen Sie sich vor: Ein heißer Sommertag, Sie bringen durstig die leere Wasserkiste zurück zum Getränkemarkt, doch Sie bekommen erst einmal keine neue. Der Händler sagt Ihnen, Sie müssen so lange warten, bis die Flaschen aus Ihrer Kiste gesäubert, frisch befüllt und neu sortiert sind… Glücklicherweise ist das Recyceln der Flaschen schon längst geschehen – zumindest derer, die Sie (oder Ihr Nachbar) schon letzte Woche zurückgebracht haben.
Die Kommunikation zwischen Nervenzellen scheint nach dem gleichen Prinzip zu funktionieren: Signale werden übertragen, indem die eine Zelle Stoffe ausschleust, die an der anderen Zelle eine elekrtrische Antwort auslösen. Die Ausschleusung nennt man Exozytose. Hierbei verschmelzen Vesikel an der Synapse mit der Plasmamembran der Zelle und setzen dabei chemische Botenstoffe, die Neurotransmitter, frei. Dabei gelangen auch die in der Membran des Vesikels enthaltenen Proteine in die Außenmembran der Synapse. Bei der Neubildung von Vesikeln müssen diese Proteine durch einen umgekehrten Vorgang, die Endozytose, wieder zurück gewonnen werden. Die Geschwindigkeit dieses Prozesses ist entscheidend dafür, wie schnell und dauerhaft Synapsen zwischen Nervenzellen bei neuronaler Aktivität funktionieren.
Um die Dynamik dieser Vesikelbausteine zu verfolgen, haben die Max-Planck-Forscher diese durch gentechnische Methoden mit einer Leuchtprotein (GFP)-Domäne markiert und mit Fluoreszenzmikroskopie sichtbar gemacht. Überraschenderweise zeigte sich, dass sich eine gewisse Zahl von Vesikelproteinen, wie etwa Synaptobrevin oder Synaptotagmin, bereits während der Ruhephase der Synapse in der Plasmamembran befindet.
Doch bisher war unklar, ob diese „gestrandeten“ Proteine am Recycling der Vesikel teilnehmen, und wenn ja, welche Funktion sie dann ausüben. Hinzu kam ein weiteres Hindernis: Bislang war es nicht möglich, die Dynamik der Proteine im Vesikel getrennt davon zu untersuchen, was mit den in der Plasmamembran gestrandeten Proteine passiert. Mit zwei Tricks gelang den Forschern nun, das Schicksal beider Proteinreservoirs während synaptischer Aktivität getrennt voneinander mikroskopisch zu betrachten und in Echtzeit zu verfolgen.
Zum einen verwendeten die Wissenschaftler ein Leuchtprotein zur Markierung, das nur dann leuchtet, wenn es sich tatsächlich in der Plasmamembran befindet, im Vesikel jedoch unsichtbar bleibt. Zum anderen hatten die Forscher das Leuchtprotein gentechnisch derart verändert, dass es sich durch eine Protease – eine Art molekulare Schere – abschneiden ließ, wenn es sich auf der Plasmamembran befand.
Hierbei zeigte sich nun, dass bei der Endocytose überwiegend beschnittene Synaptobrevin und Synaptotagmin-Moleküle rezykliert wurden, also Moleküle, die schon während der Proteaseeinwirkung in der Plasmamembran lokalisiert waren.
Die Vesikel scheinen also ihre Identität hinsichtlich der Proteinzusammensetzung im Recycling-Zyklus nicht zu behalten. Schlussfolgerung: Die Moleküle in der Plasmamembran bilden vorsortierte Strukturen aus, die bei Bedarf sofort bei Beginn der neuronalen Erregung aufnahmebereit sind. Es muss somit nicht erst auf „Neuankömmlinge“ gewartet werden, also auf Moleküle, die während der Exozytose freigesetzt werden, sondern es werden – direkt und schnell – jene Proteine verwendet, die sich im Reservoir der Plasmamembran befinden.
Der unerwartete Befund, dass Vesikel, die durch einen Nervenstimulus erst für die Weitergabe einer Information (Exocytose) verwendet und dann recycelt (Endocytose) werden, nicht dieselben Proteine enthalten, wirft ein völlig neues Licht auf einen über 30 Jahre währenden wissenschaftlichen Disput: Kollabieren alle Vesikel bei der Fusion in die Plasmamembran, und werden ihre Komponenten dann andernorts von so genannten Adaptorproteinen und dem Protein Clathrin wieder gesammelt und endocytiert? Oder gehen Vesikel nur eine kurzzeitige Liason mit der Plasmamembran über eine Fusionspore ein, durch die der Botenstoff freigesetzt werden kann („Kiss and Run“-Mechanismus)?
Die neuen Forschungsergebnisse legen nun nahe, dass Vesikel – entgegen bisheriger Annahmen – immer in die Plasmamembran kollabieren und dort ihre Identität verlieren. Da aber die molekulare Identität das wesentliche Merkmal und der entscheidende Vorteil eines „Kiss and Run“-Mechanismus ist, scheidet dieser Mechanismus damit für ein effektives Recycling klar aus. Statt der neu in die Plasmamembran integrierten Vesikelproteine werden offenbar immer andere, bei früheren Stimulationen bereits gestrandete Moleküle am Rande der Freisetzungszone in einem Membranfleck mit Hilfe der Clathrin-Maschinerie vorsortiert, konzentriert und für die Endozytose bereit gestellt. Die Zelle verfügt also über einen vorsortierten bzw. leicht zurück gewinnbaren Pool an benötigten Proteinen.
Auf diese Weise wird einerseits verhindert, dass die Membran der Synapse übermäßig anschwillt, andererseits wird sichergestellt, dass ständig ausreichend neue Vesikel zur Verfügung stehen. Vesikel werden also immer wieder neu zusammengesetzt. Tatsächlich deutet viel daraufhin, dass auch bei der Neubildung einer Synapse die zugehörigen Vesikel de novo aus dem gestrandeten Pool von Proteinen an der Plasmamembran gebildet werden.
Die neuen Befunde legen somit nahe, dass sich in der Evolution ein molekularer Mechanismus durchgesetzt hat, der sowohl die Neusynthese als auch das Recycling synaptischer Vesikel regelt.
Doch wenn die frisch freigesetzten Proteine nicht ihre eigene Rücknahme durch Endocytose triggern, welches Signal koppelt dann mit so erstaunlicher Präzision die Exocytose und kompensatorische Endocytose von neu ‚erfundenen’ Vesikeln? Dieser Frage wollen sich die Forscher nun als nächstes zuwenden.
Originalveröffentlichung:
Martin Wienisch& Jurgen Klingauf
Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical
Nature Neuroscience, Advanced Online Publication, 16 July 2006
Media Contact
Weitere Informationen:
http://www.mpg.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Erstmals 6G-Mobilfunk in Alpen getestet
Forschende der Universität Stuttgart erzielen leistungsstärkste Verbindung. Notrufe selbst in entlegenen Gegenden absetzen und dabei hohe Datenmengen in Echtzeit übertragen? Das soll möglich werden mit der sechsten Mobilfunkgeneration – kurz…

Neues Sensornetzwerk registriert ungewöhnliches Schwarmbeben im Vogtland
Das soeben fertig installierte Überwachungsnetz aus seismischen Sensoren in Bohrlöchern zeichnete Tausende Erdbebensignale auf – ein einzigartiger Datensatz zur Erforschung der Ursache von Schwarmbeben. Seit dem 20. März registriert ein…

Bestandsmanagement optimieren
Crateflow ermöglicht präzise KI-basierte Nachfrageprognosen. Eine zentrale Herausforderung für Unternehmen liegt darin, Über- und Unterbestände zu kontrollieren und Lieferketten störungsresistent zu gestalten. Dabei helfen Nachfrage-Prognosen, die Faktoren wie Lagerbestände, Bestellmengen,…





















