Das "Duale System" der Zelle
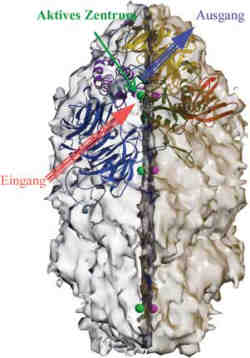
Abb. 1: Die äußere Form der Tricorn-Protease ist durch eine Oberflächendarstellung angedeutet. Tricorn besitzt insgesamt sechs aktive Zentren, die durch grüne und lila Bälle symbolisiert sind. Die zu einem Zentrum gehörigen Strukturelemente sind in einer vereinfachten Bänderrepräsentation dargestellt. Die unterschiedliche Farbcodierung deutet an, dass sich eine Untereinheit wie ein Mosaik aus fünf in sich besonders kompakten Faltungsdomänen zusammensetzt. Wie in einem Uhrwerk greifen die einzelnen Module ineinander und ermöglichen so das kontrollierte Weiterzerlegen der Proteasom-Schnipsel. Propellerartige Module führen die Proteasom-Schnipsel zum aktiven Zentrum hin (blau) und die im Tricorn entstehenden Minischnipseln wieder weg (gelb). <br> <br>Grafik: Max-Planck-Institut für Biochemie <br> <br>
Max-Planck-Wissenschaftler entschlüsseln atomaren Bauplan der Tricorn-Protease, der Wiederverwertungsmaschine für zelluläre Abfallprodukte
Das Überleben von Zellen hängt wesentlich davon ab, wie es ihnen gelingt, eigene Ressourcen effizient zu nutzen. Dazu gehört nicht zuletzt die Aufarbeitung, Wiederverwendung oder die Beseitigung unbrauchbarer oder überflüssiger Zellbestandteile. Wissenschaftlern vom Max-Planck-Institut für Biochemie in Martinsried ist es jetzt gelungen, den Bauplan und den Funktionsmechanismus der für diese Arbeit verantwortlichen molekularen Maschine in der Zelle, der Tricorn-Protease, bis ins atomare Detail aufzuklären (nature, 22. November 2001).
Jede lebende Zelle ist ein komplexes System, in dem überflüssig gewordene oder fehlerhafte Komponenten laufend beseitigt werden müssen. Seit längerem war bekannt, dass hierbei das Proteasom eine wichtige Rolle spielt. Es dient gewissermaßen als Reißwolf, der unnötige Zellbestandteile (Proteine) zerkleinert. Allerdings löst das Proteasom das Abfallbeseitigungsproblem noch nicht, sondern verlagert es zunächst nur auf eine andere Ebene, denn es generiert zwar eine Vielzahl von „Proteinschnipseln“ (kurze Ketten von etwa acht „Aminosäuren“), die für die Zelle jedoch in der Regel weiterhin noch unbrauchbaren Ballast darstellen. Doch wie in unserem Alltag, kommt es auch in der mikroskopischen Welt der Zellen darauf an, mit den zur Verfügung stehenden Ressourcen effizient zu haushalten. Einmal aus dem Gleichgewicht gebracht, kann das entstehende „Müllproblem“ dort zu ernsthaften Krankheiten wie Alzheimer oder Krebs führen. Daher suchten Wissenschaftler weltweit fieberhaft nach der Lösung des zellulären Abfallproblems – und wurden vor etwa fünf Jahren zunächst in „einfachen“ archae-bakteriellen Zellen fündig. Eine Forschergruppe um Prof. Wolfgang Baumeister am Max-Planck-Institut für Biochemie in Martinsried konnte damals die Tricorn-Protease identifizieren, ein gigantisches Protein, das die vom Proteasom erzeugten Proteinschnipsel weiter verarbeitet. Wissenschaftlern aus der von Nobelpreisträger Prof. Robert Huber geleiteten Abteilung „Strukturforschung“ des selben Max-Planck-Instituts gelang nun der Durchbruch bei der Aufklärung der atomaren Struktur der Tricorn-Protease. Sie förderten einen dreidimensionalen Bauplan von schier erdrückender Komplexität zutage, der schlagartig auch viele neue Details über den Wirkungsmechanismus der Tricorn-Protease verrät.
Die bereits vom Proteasom erzeugten Proteinschnipsel werden trichterartig in die Tricorn-Protease eingespeist und dann – über ein Kanalsystem – an ihre „Werkbank“, das so genannte katalytische Zentrum, herangeführt. Dort sorgen zwei „Türsteher“ (positiv geladene Aminosäuren) dafür, dass die wackligen Proteasomschnipsel exakt in Position und Orientierung eingespannt werden, damit sie effizient in kleinere Teile zerschnitten werden können. Dazu benutzt das Tricorn eine Salami-Schneide-Technik: Zuerst wird vom hinteren Ende des Proteinschnipsels ein kurzes Stück (zwei oder drei Aminosäuren) abgeschnitten und aus dem Tricorn entfernt. Danach ziehen die beiden Aminosäure-Türsteher den verbleibenden Proteinschnipsel weiter in das Tricorn hinein. Dieser Vorgang wiederholt sich so oft, bis die ursprünglich aus dem Proteasom kommende Aminosäurekette vollständig in kurze Mini-Schnipsel zerlegt ist. Doch was passiert mit diesen im Tricorn anfallenden Mini-Schnipseln? Sie werden durch einen molekularen „Auspuff“, ein weiteres Kanalsystem, aus dem Inneren der Tricorn-Protease wieder an ihre Oberfläche geleitet. Bei der Untersuchung dieses ungewöhnlich elastischen Kanalsystems fanden die Martinsrieder Strukturforscher starke Hinweise dafür, dass der Tricorn-Auspuff-Kanal als Eingangstrichter in ein weiteres Protein („F1“) mündet. Dieses F1-Protein wandelt die Mini-Schnipsel aus dem Tricorn in einzelne Aminosäuren um, womit der Abfallwiederverwertungszyklus geschlossen ist. Einzelne Aminosäuren können nämlich von der Zelle wieder dazu verwendet werden, neue Proteine für aktuelle Bedürfnisse herzustellen.
Die Tricorn-Protease verkörpert demnach das Herzstück einer hoch komplexen Demontagestraße für Proteine. Die einzelnen Module sind fließbandartig hintereinander angeordnet, was die Bedeutung der kanalisierten Einspeisung der Proteinschnipsel in die jeweils nächste Demontage-Einheit unterstreicht. Für diese scheinbar aufwändige Infrastruktur haben die Wissenschaftler eine einfache Erklärung: Mit zunehmender Aufspaltung der Proteine (abnehmende Schnipsellänge) steigt die Anzahl der Abfallprodukte. Für die Bewältigung der damit verbundenen logistischen Anforderungen ist eine Fließbandabfertigung die ideale Lösung.
Jetzt wollen die Martinsrieder Wissenschaftler untersuchen, welche Bedeutung die jeweils anfallenden Zwischenprodukte in der Zelle haben. Sie werden dazu – unter Zuhilfenahme der gewonnenen Strukturinformationen – an ausgewählten Elementen des Fließbandes gezielt in die Protein-Demontage eingreifen. Hans Brandstetter, Leiter des Forscherteams, bemerkt dazu: „Davon erhoffen wir uns ein besseres Verständnis der Stresssituationen in der Zelle, bei denen die alltägliche Balance zwischen Abfallvermeidung und Wiederaufbereitung gestört ist.“ Brandstetter weiter: “ Wir haben mit Bewunderung festgestellt, dass die Natur auf molekularer Ebene schon lange über ein ausgetüfteltes Recycling-System verfügt, das wir mit dem ‚Grünen Punkt’ bzw. dem ‚Dualen System’ erst noch erreichen wollen.“
Media Contact
Weitere Informationen:
http://www.mpg.de/index.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…
Durchbruch bei CRISPR/Cas
Optimierte Genschere erlaubt den stabilen Einbau von großen Genen. Großer Fortschritt an der CRISPR-Front. Wissenschaftlern des Leibniz-Instituts für Pflanzenbiochemie (IPB) ist es erstmals gelungen, sehr effizient große Gen-Abschnitte stabil und…

Rittal TX Colo: Das neue Rack für Colocation Data Center
Rittal TX Colo: Flexibel, skalierbar und zukunftssicher Mit der zunehmenden Digitalisierung und künftig auch immer mehr KI-Anwendungen steigt der Bedarf an Rechenleistung signifikant – und damit boomt der Colocation-Markt. Unternehmen…





















