Schnappschüsse vom molekularen Postversand in der Zelle
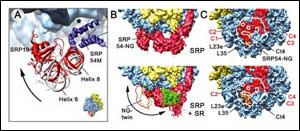
Die Umlagerung von SRP am Ribosom exponiert die Translokon-Bindungsstelle. Bild: Max-Planck-Institut für molekulare Genetik
Berliner Forschungsverbund gelingen wichtige Einblicke in die Synthese- und Sortiermaschinerie für sekretorische und Membranproteine
Die meisten Proteine haben in einer Zelle einen ganz genauen Bestimmungsort, an dem sie ihre Funktion ausüben. Doch wie gelangen sie dorthin? Wissenschaftlern der Charité Berlin, der Universität Heidelberg und des Berliner Max-Planck-Instituts für molekulare Genetik ist es jetzt – mittels Kryo-Elektronenmikroskopie und Einzelpartikelanalyse – gelungen, die Struktur einer daran beteiligten „molekularen Maschine“ sichtbar zu machen. Diese besteht aus einem aktiven Ribosom sowie einem speziellen Signalerkennungsprotein und dem zugehörigen Rezeptor. Die Strukturaufklärung zeigt nun, dass bei der Interaktion der drei Proteine spezielle Bindestellen am Ribosom zugänglich werden, die ein Ankoppeln an einen weiteren Proteinkomplex ermöglichen, der das Durchschleusen der neu produzierten Proteine durch die Membran übernimmt. Diese Einblicke helfen, die komplizierte Expression und nachfolgende Sortierung von sekretorischen bzw. Membranproteinen in der Zelle besser zu verstehen (5. Mai 2006).
Nach neuen Erkenntnissen aus der Genom- und der biologischen Strukturforschung wird immer deutlicher, dass die meisten Proteine in der Zelle nur im Verbund mit anderen Proteinen als so genannte „molekulare Maschinen“ ihre eigentlichen Funktionen ausüben können. Molekulare Maschinen – wie etwa das Ribosom – besitzen nicht nur einen äußerst komplexen Aufbau, sie unterliegen auch einer komplizierten Regulation bei ihrem Betrieb. Die zentrale Frage, wie die einzelnen Partner dabei zusammenarbeiten, damit die jeweiligen Körperfunktionen reibungslos ablaufen können, ist daher eine der großen Herausforderung in der modernen Strukturbiologie.
Die Sortierung von Proteinen ist ein essentieller Schritt bei der Genexpression aller Organismen, von den Bakterien bis hin zum Menschen. Von entscheidender Bedeutung ist das Sortieren bei der Biosynthese von sekretorischen Proteinen, also Proteinen, die später aus der Zelle ausgeschleust werden, wie etwa Antikörper, sowie von Membranproteinen, wie etwa Rezeptoren für neuronale Botenstoffe und andere Signalmoleküle. Etwa 30 Prozent aller Proteine in Genom von eukaryotischen Zellen sind entweder sekretorische oder Membranproteine. Die Mehrzahl dieser Proteine wird bereits während ihrer Biosynthese in einem Mechanismus sortiert, den man als kotranslationale Translokation bezeichnet.
Besonders wichtig ist dabei ein molekularer Komplex, der aus einem aktivem Ribosom, also einer Protein-Synthese-Maschine der Zelle, sowie einem Signalerkennungsprotein (engl. signal recognition particle, SRP) und dem entsprechenden Rezeptor gebildet wird. Die Struktur dieses molekularen Komplexes aufzuklären ist nun dem Wissenschaftlerteam von Charité, Universität Heidelberg und Max-Planck-Institut für molekulare Genetik gelungen.
Schlüsselelement für die Funktionsweise dieser molekularen Maschine ist eine Signalsequenz, die sich am N-terminalen Ende der zu sortierenden Proteine befindet. Diese Sequenz fungiert quasi als „Postleitzahl“ in der Zelle. Das Signalerkennungsprotein (SRP) liest diese Sequenz, sobald sie das Ribosom am Anfang einer gerade neu-gebildeten Proteinkette verlässt. SRP bindet an das Ribosom und leitet dieses unter Beteiligung des SRP-Rezeptors zum so genannten Translokon-Komplex in der Membran des endoplasmatischen Reticulums (ER). Dieser Komplex wiederum besteht aus einem „proteinleitenden Kanal“ und weiteren Membranproteinen. Das Ribosom wird am Translokon verankert und fährt erst dort mit der Proteinbiosynthese fort, wobei die neue Proteinkette dann entweder durch die Membran des endoplasmatischen Reticulums transportiert (Translokation) oder in diese selbst eingebaut wird.
Hierbei ist bemerkenswert, dass das Ribosom nicht mehr an das Translokon binden kann, sobald es SRP gebunden hat. Hierzu benötigt es die Unterstützung des SRP-Rezeptors, der das Ribosom von SRP auf das Translokon überträgt. Die nun aufgeklärte Struktur des Komplexes zeigt, wie der Rezeptor mit dem Ribosom bzw. SRP interagiert und hierbei Teile des SRP-Moleküls vom Ribosom verdrängt. Erst auf diese Weise werden spezifischen Bindestellen am Ribosom für das Translokon zugänglich. Die Aufklärung dieses Schrittes ist ein wichtiger Baustein zum Verständnis, auf welche Weise die komplizierte Expression von sekretorischen bzw. Membranproteinen in der Zelle funktioniert.
Das Berliner UltraStrukturNetzwerk (USN)
Das UltraStrukturNetzwerk ist ein Projektverbund, der sich zum Ziel gesetzt hat, komplizierte „molekulare Maschinen“ mit modernsten Methoden wie der Massenspektrometrie (MS) und der Kryo-Elektronenmikroskopie (Kryo-EM) zu untersuchen. Der Verbund wurde vom Max-Planck-Institut für molekulare Genetik in Kooperation mit der Charité initiiert und vernetzt inzwischen mehr als 15 Arbeitsgruppen in der Region Berlin-Brandenburg. Neben den drei Berliner Universitäten FU, TU und HU gehören dazu auch das Max-Delbrück-Centrum für Molekulare Medizin, Leibniz-Institut für Molekulare Pharmakologie (FMP), die Universität Potsdam sowie das Max-Planck-Institut für molekulare Pflanzenphysiologie in Potsdam.
Mit Unterstützung durch Europäische Fördermittel und der Berliner Senatsverwaltung für Wissenschaft, Forschung und Kultur (Gesamtvolumen: 8 Mio. Euro) wurde im UltraStrukturNetzwerk die technologische Infrastruktur für die Analyse von „molekularen Maschinen“ geschaffen. Die Core-Facilities, darunter ein 300 kV Tecnai G2 Polara Kryo-Elektronenmikroskop, sind am Max-Planck-Institut für molekulare Genetik lokalisiert. Die Strukturaufklärung des Ribosom-SRP-SRP-Rezeptor-Komplexes gehört zu den ersten Forschungsergebnissen, die bereits in der Aufbauphase des USN erzielt werden konnten.[TM]
Originalveröffentlichung:
Mario Halic, Marco Gartmann, Oliver Schlenker, Thorsten Mielke, Martin R. Pool, Irmgard Sinning, Roland Beckmann
Signal Recognition Particle Receptor Exposes the Ribosomal Translocon Binding Site
Science, 5 May 2006
Media Contact
Weitere Informationen:
http://www.mpg.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















