Tanz der Wassermoleküle in Proteinen in Echtzeit aufgelöst
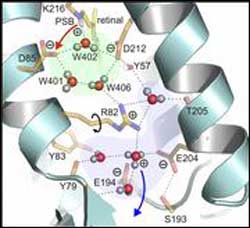
Blick in das aktive Zentrum des Proteins mit der exakten Anordnung der Wassermoleküle. Angezeigt sind die Protonentransferreaktionen <br>Garzcarek/Gerwert, NATURE
Neuer Ansatz ermöglicht bewegte Bilder der Proteinfunktion – RUB-Biophysiker berichten in NATURE
Schon die antiken Griechen ahnten: Wasser ist der Quell des Lebens. Dieser Ahnung gingen die RUB-Biophysiker Dr. Florian Garzcarek und Prof. Dr. Klaus Gerwert in der Nano-Welt der Proteine, den Bausteinen des Lebens, auf den Grund: Sie konnten erstmals zeigen, wie ein Membranprotein gezielt das Zusammenspiel einzelner Wassermoleküle nutzt, um seine Arbeit zu verrichten, nämlich von der Sonne angetrieben Protonen gegen einen äußeren Widerstand zu pumpen. Entgegen der herrschenden Lehrmeinung können Wassermoleküle genau wie Aminosäuren Funktionen in einem Protein übernehmen. „Die katalytische Funktion der Proteine ist essentiell für die Regulierung biologischer Prozesse, und proteingebundenes Wasser spielt dabei eine zentrale Rolle“, erklärt Prof. Gerwert. Diese Ergebnisse sind bereits vor dem Druck in der online-Ausgabe von NATURE veroeffentlicht.
Die „Arme“ sind wichtig
So wie bei einem tanzenden Paar die Bewegungen der Arme eine zentrale Rolle spielen, sind die Interaktionen der beiden an dem zentralen Sauerstoff (O) gebundenen Wasserstoffarme (H) wichtig für die Funktion der Wassermoleküle (H2O) im Protein. Ein im Labor von Prof. Gerwert entwickelter, vibrationsspektroskopischer Ansatz erlaubte es den Forschern nun erstmals, die Wasserstoffe einzelner proteingebundener Wasser und ihre vielfältigen Interaktionen während der Katalyse eines Membranproteins in Echtzeit aufzulösen. „Bisher konnte in den Proteinstrukturen nur die Position der Sauerstoffatome des proteingebundenen Wassers aufgelöst werden, nicht aber die der Wasserstoffe und insbesondere nicht deren Dynamik“, erläutert Prof. Gerwert. Ohne Kenntnis über die Position und Dynamik der Arme konnte den Wassermolekülen bisher auch keine Funktion zugeordnet werden. „Die Ergebnisse unserer Untersuchungen stellen einen Paradigmenwechsel in der Bedeutung der proteingebundenen Wassermoleküle für die Funktion von Proteinen dar“, so Gerwert.
Fortschritt in der Entwicklung medizinischer Wirkstoffe
Auswirkungen könnte die neue Untersuchungsmethode etwa auf die Entwicklung neuer Medikamente haben: Die Rolle der Wassermoleküle wird z.B. in den Modelling Verfahren der Pharmaindustrie, in denen neue Wirkstoffe entwickelt werden, bisher gar nicht oder nur sehr rudimentär berücksichtigt. „Kann man die Rolle Protein-gebundener Wasser in solche Verfahren mit einbeziehen, sollte dies einen erheblichen Fortschritt bei der Entwicklung von neuen Wirkstoffen auslösen“, schätzt Prof. Gerwert. Die Vibrationsspektroskopie könne zu einer Schlüsseltechnik im Bereich der System-Biologie werden, da sie die Dynamik der Proteine und ihre Interaktionen in Proteinnetzwerken auflösen kann. Die aktuellen Ergebnisse schlagen darüber hinaus eine Brücke von der Welt der Physiko-Chemiker zu der Welt der Biochemiker: Es zeigt sich, dass die in den physiko-chemischen Systemen entdeckten Eigenschaften der Wasser geschickt von einem Protein genutzt werden, um seine biologische Funktion optimal zu realisieren.
Hintergrund: Bisher nur Standbilder
Die Biowissenschaftler versuchen, ausgehend von Fragestellungen auf der phänomenologischen Ebene, die Prozesse auf der zellulären und schließlich auf der molekularen Ebene zu verstehen. Das ist eine wesentliche Voraussetzung dafür, gezielter in patho-physiologische Prozesse eingreifen zu können. Auf der molekularen Ebene rücken im „postgenomen“ Zeitalter funktionstragende Proteine in den Fokus der Forscher. Mit der Röntgenstrukturanalyse kann man ihre dreidimensionale Struktur bestimmen. Um allerdings die Funktion zu verstehen, benötigt man weiterführende Methoden, die eine echte atomare Auflösung liefern. Die Röntgenstrukturanalyse löst in der Regel die Wasserstoffatome nicht auf und liefert den eingefrorenen Grundzustand der Proteine, die Reaktionen der Schlüsselgruppen werden dagegen nicht aufgelöst. „Diese klassischen Methoden liefern bildlich gesprochen einen Schnappschuss von einem kalten Motor, aber nicht aber einen ganzen Film, der den laufenden Motor mit seinen vielen fein aufeinander abgestimmten Bauteilen in Aktion zeigt“, so Gerwert. „Für das Verständnis des Zusammenspiels der einzelnen Proteine in den komplexen Signaltransduktions-Netzwerken der Zelle ist aber ueber die Struktur hinaus die Bestimmung der Dynamik der Proteine und ihrer Interaktionen wesentlich.“ Kommt es zu Störungen in den Signalwegen, beginnt die Zelle unkontrolliert zu wachsen und es bilden sich Krankheiten wie Krebs aus.
Titelaufnahme
Florian Garczarek &Klaus Gerwert: Functional waters in intraprotein proton transfer monitored by FTIR difference spectroscopy. In: Nature; DOI: 10.1038/nature04231
Weitere Informationen
Prof. Dr. Klaus Gerwert, Lehrstuhl für Biophysik der Ruhr-Universität Bochum, 44780 Bochum, ND 04/596, Tel. 0234/32-24461, Fax: 0234/32-14238, E-Mail: gerwert@bph.rub.de
Media Contact
Weitere Informationen:
http://www.pm.ruhr-uni-bochum.de/pm2005/msg00081.htmAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern-befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















