Ein Biomolekül als Lichtschalter

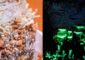
Wachsrose (Anemonia sulcata). Bild: Richard Lockett
Forscher des Göttinger Max-Planck-Instituts für biophysikalische Chemie haben molekularen Mechanismus eines schaltbaren fluoreszierenden Proteins aufgeklärt
Schaltbare fluoreszierende Proteine, die sich reversibel zwischen einem ‚Ein’- und einem ‚Aus’-Zustand hin und herschalten lassen, sind erst seit wenigen Jahren bekannt, versprechen aber bereits eine Vielzahl neuartiger Anwendungen von der Zellbiologie bis hin zu Datenspeicherung. In einem Kooperationsprojekt haben Göttinger Zellbiologen, Röntgenkristallografen, Photobiophysiker und Computer-Biophysiker jetzt den molekularen Mechanismus entschlüsselt, mit dem ein fluoreszierendes Protein geschaltet wird (PNAS, 13. September 2005). Dieses Wissen könnte unter anderem für die optische Datenspeicherung in Proteinkristallen von Bedeutung sein.
Das fluoreszierende Protein mit der Bezeichnung asFP595 kommt in den Tentakelspitzen der Wachsrose Anemonia sulcata vor, einer Korallenart, die in den lichtdurchfluteten Flachwasserbereichen des Mittelmeers und des Nordatlantiks lebt (s. Abb. 1). In den Tentakelspitzen schützt dieses Protein die darunter liegenden Gewebe der Anemone wahrscheinlich vor zu starker Sonneneinstrahlung. asFP595 absorbiert grünes Licht und strahlt anschließend rotes Fluoreszenz-Licht wieder ab. Das Protein kann durch Licht beliebig zwischen einem fluoreszierenden und einem nicht-fluoreszierenden Zustand hin- und her geschaltet werden. Es ist ein ‚molekularer Lichtschalter’.
Die Göttinger Forscher haben den Mechanismus dieses molekularen Schalters aufgeklärt, indem sie das Protein zunächst in Bakterien hergestellt und dann Kristalle aus dem aufgereinigten Protein gezüchtet haben, die noch die Schalteigenschaften des freien Proteins besitzen. Röntgenstrukturanalysen und Computersimulationen zeigten, dass das Chromophor – der Teil des Proteins, der das Licht absorbiert – durch Beleuchtung mittels einer Cis-Trans-Isomerisierung seine Struktur ändert. Während das Chromophor einen so genannten Hula-Twist macht, ändert es seine Position um lediglich 3 x 10-10 Meter (ein Drittel eines Milliardstel Meters). Diese winzige Änderung reicht aus, um aus dem fluoreszierenden ein nicht-fluoreszierendes Protein zu machen.
Aufbauend auf diesem Wissen wollen die Forscher nun das Protein gezielt für den Einsatz in verschiedene Anwendungen verbessern. Diese reichen vom Einsatz in der höchstauflösenden Mikroskopie bis hin zur optischen Datenspeicherung in Proteinkristallen.
Originalveröffentlichung:
Andresen, M., Wahl, M. C., Stiel, A. C., Gräter, F., Schäfer, L. V., Trowitzsch, S., Weber, G., Eggeling, C., Grubmüller, H., Hell, S. W. & Jakobs, S.
Structure and mechanism of the reversible photoswitch of a fluorescent protein
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…