Multiple Sulfatasedefizienz: Atomare Struktur eines wichtigen Enzyms entschlüsselt
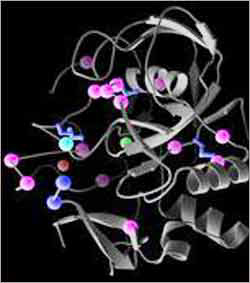
Molekulare Basis der Multiplen Sulfatasedefizienz (MSD): Die Struktur des Formylglycin-generierenden Enzyms (FGE) ist als Bänderdiagramm in grau dargestellt. Krankheitsverursachende Mutationen, die bislang in MSD-Patienten gefunden wurden, sind als farbige Kugeln hervorgehoben. Die Farbe gibt an, ob die jeweilige Mutation zur Destabilisierung der Struktur (rosa), zur Hemmung der Sulfatase-Bindung (blau) oder zur Blockierung der Enzymaktivität (türkis) führt.
Einen wichtigen Baustein im Verständnis der Multiplen Sulfatasedefizienz (MSD), einer seltenen und tödlich verlaufenden Erbkrankheit bei Kindern, haben Mediziner, Biochemiker und Biologen der Universität Göttingen entschlüsselt:
Sie konnten die atomare Struktur eines Enzyms ermitteln, das die Sulfatasen in menschlichen Zellen aktiviert. Bei MSD kommt es zu einem Ausfall aller Sulfataseaktivitäten, der massive Funktionsstörungen zahlreicher Organe nach sich zieht. Die Suche nach Ursachen für das Fehlen aller Sulfatasen bei MSD-Patienten führte die Göttinger Forscher um den Biochemiker Prof. Dr. Kurt von Figura zunächst zu der Entdeckung, dass die Sulfatasen durch eine einzigartige neue Aminosäure mit dem Namen Formylglycin gekennzeichnet sind. Jetzt haben die Wissenschaftler das Enzym in seinen Strukturen aufgeklärt, das diese besondere Aminosäure produziert. Die nun bekannten Strukturen des so genannten Formylglycin-generierenden Enzyms erlauben Einblicke in die Ursachen der Multiplen Sulfatasedefizienz, die durch genetische Mutationen ausgelöst wird. Über die aktuellen Forschungsergebnisse berichtet die Fachzeitschrift CELL in ihrer Ausgabe vom 20. Mai 2005.
Multiple Sulfatasedefizienz: Atomare Struktur eines wichtigen Enzyms entschlüsselt
Göttinger Wissenschaftler leisten einen weiteren Beitrag zum Verständnis der seltenen Erbkrankheit
Einen wichtigen Baustein im Verständnis der Multiplen Sulfatasedefizienz (MSD), einer seltenen und tödlich verlaufenden Erbkrankheit bei Kindern, haben Mediziner, Biochemiker und Biologen der Universität Göttingen entschlüsselt: Sie konnten die atomare Struktur eines Enzyms ermitteln, das die Sulfatasen in menschlichen Zellen aktiviert. Bei MSD kommt es zu einem Ausfall aller Sulfataseaktivitäten, der massive Funktionsstörungen zahlreicher Organe nach sich zieht. Die Suche nach Ursachen für das Fehlen aller Sulfatasen bei MSD-Patienten führte die Göttinger Forscher um den Biochemiker Prof. Dr. Kurt von Figura zunächst zu der Entdeckung, dass die Sulfatasen durch eine einzigartige neue Aminosäure mit dem Namen Formylglycin gekennzeichnet sind. Jetzt haben die Wissenschaftler das Enzym in seinen Strukturen aufgeklärt, das diese besondere Aminosäure produziert. Die nun bekannten Strukturen des so genannten Formylglycin-generierenden Enzyms erlauben Einblicke in die Ursachen der Multiplen Sulfatasedefizienz, die durch genetische Mutationen ausgelöst wird. Über die aktuellen Forschungsergebnisse berichtet die Fachzeitschrift CELL in ihrer Ausgabe vom 20. Mai 2005.
Bei den Sulfatasen handelt es sich um Enzyme, die Schwefelsäuregruppen bei einer Vielzahl von Molekülen abspalten. Fehlen diese Sulfatasen, werden die Entwicklung und die Funktion vieler Organsysteme, darunter auch das Nervensystem, gestört. Bereits vor zwei Jahren konnten die Biochemiker Prof. Dr. Thomas Dierks und Dr. Bernhard Schmidt das Gen isolieren, dessen Defekt den Ausfall der Sulfataseaktivitäten verursacht. Dieses Gen verschlüsselt eben jenes Formylglycin-generierende Enzym (FGE), das in den Sulfatasen die Aminosäure Formylglycin erzeugt. Diese einzigartige Aminosäure, die von den Göttinger Wissenschaftlern unter der Leitung von Prof. von Figura erstmals vor zehn Jahren nachgewiesen wurde, ist allein in Sulfatasen zu finden und tritt nirgendwo sonst in der Natur auf. Dabei ist das Formyglycin in den Sulfatasen an strategisch wichtiger Stelle angesiedelt: Die Aminosäure sitzt in dem Bereich, der für die Abspaltung von Schwefelsäuregruppen verantwortlich ist. „Damit kontrolliert das Formylglycin-generierende Enzym die Aktivitäten aller 16 Sulfatasen, die beim Menschen bekannt sind“, erläutert Prof. Dierks. Allerdings gab die im Jahr 2003 ermittelte Gensequenz keinen Aufschluss über die tatsächliche Funktionsweise des FGE.
Um das Enzym weiter erforschen zu können, haben die Göttinger Biochemiker das FGE in gentechnologischer Produktion in größerer Menge hergestellt. Daraus konnte der Strukturbiologe Dr. Markus Rudolph zusammen mit Dr. Achim Dickmanns Kristalle des Enzyms züchten. Diese Kristalle lieferten in sehr hoher Auflösung eine räumliche Struktur, die auf den ersten Blick sehr „unregelmäßig“ erscheint. „So ungewöhnlich die Aminosäure Formylglycin ist, so außergewöhnlich ist auch die Struktur des Enzyms, das sie erzeugt“, so Dr. Rudolph. Mit der Strukturanalyse erhielten die Wissenschaftler zugleich einen Einblick in die überraschende Funktion des Enzyms. „Das FGE benutzt molekularen Sauerstoff, den es auf eine erstaunlich einfache, bislang nicht für möglich gehaltene Weise in die Sulfatasen einbauen kann – ohne die Beteiligung von Metallen oder anderen kompliziert aufgebauten Faktoren“, sagt der Wissenschaftler, der in der Abteilung für Molekulare Strukturbiologie eine von der Deutschen Forschungsgemeinschaft geförderte Forschernachwuchsgruppe leitet.
Die Göttinger Forscher wollen nun an einer weiteren Aufklärung der Funktionsweise von FGE arbeiten. Das Enzym ist der erste funktionell charaktersierte Vertreter einer neuartigen, weitverbreiteten Proteinfamilie, die in ein- und vielzelligen Organismen von Bakterien bis zum Menschen nachweisbar ist. „So ist die Multiple Sulfatasedefizienz ein Beispiel dafür, wie durch die Suche nach den Ursachen einer seltenen Erkrankung das Verständnis der gesamten Biologie erweitert werden kann“, betont Prof. von Figura. Das Formylglycin-generierende Enzym wird inzwischen in einem biotechnologischen Verfahren eingesetzt, um mehrere Sulfatasen effizient herzustellen und sie für die Therapie von einzelnen Sulfatasedefizienz-Erkrankungen zu nutzen.
Media Contact
Weitere Informationen:
http://www.uni-goettingen.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















