Auf dem Weg zu kontrollierten Nano-Transportern
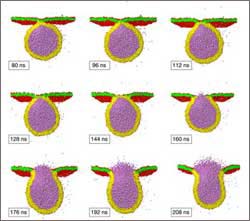
Verschmelzungsprozess einer Vesikel (gelb/orange) mit einem Durchmesser von 28 Nanometern mit einer flachen Membran (grün/rot) mit einer Fläche von 50 x 50 nm2. Die lila Partikel innerhalb der Vesikel stellen Wassermoleküle dar; die dazu korrespondierenden Partikel außerhalb der Vesikel sind aus Gründen der Übersichtlichkeit nicht dargestellt. Die neun Momentaufnahmen zeigen die zeitliche Entwicklung des Verschmelzungsprozesses im Zeitraum zwischen 80 und 218 Nanosekunden (ns). Bild: MPI für Kolloid- und Grenzflächenforschung
Potsdamer Max-Planck-Wissenschaftler decken die molekularen Mechanismen bei der Verschmelzung von Vesikeln und Membranen auf
Bei der Signalübertragung, beispielsweise zwischen Nervenzellen, verschmelzen winzige Transportbläschen, so genannte Vesikel, mit der Membran und setzen so ihren chemischen Inhalt frei. Diese Verschmelzung dauert weniger als eine Millisekunde und lässt sich daher mit den gegenwärtig verfügbaren Methoden experimentell nicht genau untersuchen. Am Max-Planck-Institut für Kolloid- und Grenzflächenforschung ist es Wissenschaftlern nun gelungen, mittels Computersimulationen Fusionsprozesse mit molekularer Auflösung zu beobachten. Dabei zeigt sich, dass die Membranfusion durch die anfänglichen Spannungen innerhalb der Membranen gesteuert werden. Die Verschmelzung läuft nur bei mittleren Spannungen ab, dann aber sehr schnell, innerhalb von 200 Nanosekunden. (Nature Materials, Advanced Online Publication, February 13, 2005).
Jede Körperzelle enthält eine große Anzahl von Vesikeln und anderen Zellorganellen, die von Membranen eingehüllt sind. Vesikel fungieren als Transportvehikel, die einzelne „Frachten“ (Botenstoffe und andere chemische Substanzen) zwischen den verschiedenen Bereichen „hin- und herfahren“; die „Lieferung“ erfolgt dabei immer über Membranfusionen: Indem die Vesikel mit einer Membran verschmilzt, setzt sie ihren chemischen Inhalt frei. Die Verschmelzung beispielsweise synaptischer Vesikel mit den äußeren Membranen von Nervenzellen steuert die Kommunikation zwischen den Zellen. Dabei wird der entsprechende Botenstoff in den synaptischen Spalt freigesetzt. Membranfusionen bilden somit die molekulare Basis für all unsere Gedanken. Ein weiteres, weniger erfreuliches Beispiel für derartige Fusionen ist die Virusinfektion. Viele Viren, wie auch der Grippe- oder der HIV-Virus, verstecken sich hinter einer Hüllmembran, die sie von einer infizierten Zelle „gestohlen“ haben. Nur mithilfe dieser Hüllmembran können sie wiederum mit neuen Zellen fusionieren, die auf diese Weise ebenfalls infiziert werden.
Obwohl diese Fusionprozesse grundlegend für das Leben sind, sind die molekularen Mechanismen dahinter nach wie vor unbekannt. Das liegt vor allem daran, dass sich die Verschmelzung von Membranen in winzigsten Dimensionen abspielt, nämlich auf einer Längenskala zwischen 2 und 20 Nanometern. Elektronenmikroskopie oder Rasterkraftmikroskopie sind zwar in der Lage diese Längenskalen zu erfassen, dafür müssen die Membranen aber gefroren oder auf einer Oberfläche immobilisiert werden. Folge: Sie können nicht mehr miteinander verschmelzen. Der Vereinigungsprozess verläuft außerdem so schnell, dass er sich bislang nicht zeitlich erfassen ließ; und er schließt viele verschiedene Moleküle – Lipide und Proteine – ein, deren Wechselspiel während der Fusion bisher nicht aufgeklärt werden konnte.
Wissenschaftlern des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung ist es nun gelungen, mittels Computersimulationen Membranverschmelzungen mit molekularer Auflösung zu beobachten und die zugehörigen Fusionszeiten zu messen. Die Simulationen basieren auf neuen Algorithmen der sogenannten Dissipative Particle Dynamics, mit denen man eine sehr große Anzahl von Molekülen darstellen kann. Die Forscher konnten für die Fusionsprozesse das konzertierte Verhalten von 10.000 Lipidmolekülen und rund drei Millionen Wassermolekülen simulieren. Auf diese Weise war es möglich, die Interaktion von Lipidvesikeln (Durchmesser: 28 nm) mit einer flachen Lipidmembran (Fläche: 50×50 nm2) innerhalb eines Wasservolumens von 50 x 50 x 50 nm3 (siehe Bild) zu studieren.
Dabei zeigt sich, dass die Fusion durch die anfänglichen Spannungen innerhalb der beiden Membranen gesteuert wird. Die Spannung für eine Membran hängt von dem Verhältnis der Membranfläche zur Anzahl der eingebauten Lipidmoleküle ab. Wenn Vesikel und flache Membran entspannt sind, beobachten die Forscher keine Fusion; stattdessen haften die Vesikel an der flachen Membran. Ist die Vesikelmembran anfänglich zu stark gespannt, zerreißt sie noch bevor sie mit der Membran verschmelzen kann. Gleiches gilt für die Membran, wenn sie einer zu großen anfänglichen Spannung ausgesetzt wird. Daraus ergibt sich, dass die Fusion nur dann erfolgen kann, wenn die Spannungswerte für die Membran genau dazwischen liegen. „Aber auch bei diesen mittleren Spannungen führen nur 55% aller Verschmelzungsversuche zu einem erfolgreichen Resultat“, sagt Julian Shillcock. „Die restlichen Versuche liefern perforierte oder halbverschmolzene Membranen.“ Da diese halbverschmolzenen Zustände stabil werden, konnten die Forscher auch keine Verschmelzungsprozesse mit einer längeren Fusionszeit zwischen 350 Nanosekunden und 2 Mikrosekunden beobachten.
Die Fusion von biologischen Membranen wird durch Fusionsproteine gesteuert, die in den Membranen verankert sind. Diese Steuerung geschieht vermutlich dadurch, dass die Proteine ihre Faltungsstruktur ändern und auf diese Weise örtlich begrenzte Spannungen und Biegemomente auf die Membranen ausüben. Verschiedene Fusionsproteine sollten den Membranen dabei unterschiedliche Kraftmuster aufprägen. Diese örtlich begrenzten Kraftmuster können ebenfalls in den Computermodellen dargestellt werden. „Man findet wieder einen mittleren Spannungsbereich, für den Membranfusionen auftreten, mit Fusionszeiten von etwa 200 Nanosekunden“, erklärt Reinhard Lipowsky „Die lokalen Kraftmuster haben darüber hinaus den Vorteil, dass der Fusionsprozess jetzt wesentlich verlässlicher und weniger stochastisch ist, so wie man es für die Fusion von biologischen Membranen erwarten sollte.“
Die Forscher wollen ihre Simulationsstudien auf Membranen mit mehr Komponenten ausdehnen und damit die Grundlage für neue biomimetische Modellsysteme legen. Ihr Ziel: Die Systeme könnten zum Beispiel für einen intelligenten Medikamententransport benutzt werden. Zukünftig würden dann die Wirkstoffe in Vesikel eingeschlossen. Diese docken an kranken Zellen an, fusionieren mit ihnen, und geben somit ihre Fracht gezielt nur an diese Zellen ab. Aber diese Idee kleinster Nano-Transporter ist noch Zukunftsmusik.
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















