Strukturbiochemie: Blaulichttherapie für DNA-Schäden

Wie blaues Licht Schäden im Genom reparieren kann – Erstmalige Analyse der dreidimensionalen Struktur eines cyanobakteriellen Reparaturenzyms nach Bindung an UV-geschädigte Erbsubstanz
Wissenschaftler der Philipps-Universität Marburg haben gemeinsam mit einer Arbeitsgruppe der Ludwig-Maximilians-Universität München herausgefunden, wie es einige Reparaturenzyme der Erbsubstanz (DNA) schaffen, Lichtenergie zur Reparatur von DNA-Schäden einzusetzen. Den Arbeitsgruppen um den Biochemiker Professor Dr. Lars-O. Essen vom Fachbereich Chemie der Philipps-Universität und den Chemiker Professor Dr. Thomas Carell (München) gelang es erstmals, einen Komplex zu kristallisieren, der zeigt, wie ein solches Reparaturenzym eines Cyanobakteriums an einen künstlich erzeugten DNA-Schaden bindet. Dies wiederum machte es möglich, den molekularen Aufbau dieses Komplexes – und damit die Wirkungsweise des Reparaturenzyms – mit Hilfe der Röntgenstrukturanalyse aufzuklären. Die beiden Forscher sind Mitglieder der Forschergruppe „Biohybridmaterialien“ der Deutschen Forschungsgemeinschaft (DFG). Ihre im US-amerikanischen Wissenschaftsjournal Science veröffentlichte Arbeit trägt den Titel „Crystal Structure of a Photolyase Bound to a CPD-Like DNA Lesion After in Situ Repair“ (Science 2004 Dec 3;306(5702):1789-93).
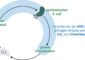
Essen und Carell waren der Frage nachgegangen, welchen Weg die von den Reparaturenzymen – so genannten Photolyasen – aufgenommene Lichtenergie nimmt, um schließlich den DNA-Schaden zu reparieren. Erstmals konnten sie im Rahmen ihrer Untersuchungen beobachten, dass der Schaden vollständig in das aktive Zentrum des Enzyms „klappt“. Das energiereiche Elektron, das durch den Lichteinfall im Enzym erzeugt wird und den Schaden repariert, muss deshalb nur einen sehr kurzen Weg zu seinem Wirkungsort zurücklegen: So kann jedes aufgenommene Lichtquant zur DNA-Reparatur ausgenutzt werden.
CPD-Schäden durch Sonnenlicht
Der ultraviolette Strahlungsanteil aus dem Sonnenlicht, besonders der noch die stratosphärische Ozonschicht passierende Rest des besonders energiereichen UV-B-Lichts, schädigt die Erbsubstanz, indem er photochemische Reaktionen zwischen den Basen der DNA auslöst. Drei Viertel dieser Schäden vom so genannten CPD-Typ (CPD: Cyclobutan-Pyrimidin-Dimere) entstehen, weil zwei benachbarte Thyminbasen eine Verbindung eingehen. Obwohl dadurch die Struktur der DNA zunächst nur geringfügig gestört wird, wirken sich CPD-Schäden sehr stark auf die Zelle aus, da die biochemischen Reaktionen zur Erhaltung und Vermehrung der Erbsubstanz an den Schädigungsstellen unvermittelt zum Halt gelangen oder zumindest Mutationen hervorrufen. Bekanntestes Beispiel für eine menschliche Erkrankung ist die oft tödlich verlaufende Erbkrankheit Xeroderma pigmentosa („Mondkinder“). Bei ihr führt der Ausfall entsprechender Reparaturenzyme schon bei geringfügigsten Einwirkungen von Sonnenlicht zu schwersten Hautschädigungen.
Die Reparatur der CPD-Schäden durch körpereigene Mechanismen wird chemisch dadurch erschwert, dass die bei der Verknüpfung der Thyminbasen ausgebildeten Cyclobutanringe nur schwer zu „knacken“ sind. Photolyasen gelingt es jedoch, die CPD-Schäden wieder zu beheben. Sie nehmen ein blaues Lichtteilchen auf – mit Hilfe von „Lichtantennen“, kleinen Farbstoffmolekülen vom Deazaflavin-Typ-, dessen Energie dann auf ein Elektron eines weiteren kleinen Moleküls, diesmal vom Flavintyp, übergeht. Dem angeregten Elektron schließlich gelingt es, die reaktionsträgen Cyclobutanringe zu aktivieren und letztlich zu „knacken“, die Verbindung der Thyminbasen wird wieder aufgebrochen.
Bislang jedoch war unklar, auf welchem Wege das Elektron auf den CPD-Schaden gelangt, wo es ihn innerhalb nur weniger Milliardstel Sekunden auflöst. Zur Klärung dieser Frage etablierte die Arbeitsgruppe um den Organochemiker Thomas Carell, der im Dezember 2003 von der Philipps-Universität Marburg nach München gewechselt war, zunächst effiziente Wege zur chemischen Synthese, also der „künstlichen Herstellung“ von CPD-Schäden an einer DNA. Mit Hilfe der Photolyase aus einer Blaualge, die von Dr. André Eker an der Universität Rotterdam präpariert worden war, gelang es Lars-O. Essen und seiner Mitarbeiterin Petra Gnau, den Schaden, das Enzym und den dazwischen liegenden Komplex zu kristallisieren und so der Röntgenstrukturanalyse zugänglich zu machen.
Durch Einsatz der Swiss Light Source (SLS) in Villigen, Schweiz, einer der für biokristallographische Studien stärksten Röntgenquellen Europas, konnten die Forscher die Struktur des Photolyase/DNA-Komplexes schließlich aufklären. Es zeigte sich, dass die Bindung des Enzyms Photolyase an die den CPD-Schaden enthaltende DNA letztere so stark verknickt, dass der CPD-Schaden vollständig in das aktive Zentrum des Enzyms klappt. Dieses nun erstmals beobachtete Herausklappen von zwei DNA-Thyminbasen aus der DNA-Doppelhelix bewirkt, dass der CPD-Schaden das genannte Molekül vom Flavintyp (den „katalytischen Kofaktor“) unmittelbar kontaktiert. Das von letzterem erzeugte energiereiche Elektron kann also auf kürzestem Wege zum Schaden gelangen.
Auch einen interessanten Nebeneffekt konnten die Forscher beobachten, als sie die harte Röntgenstrahlung der SLS auf die Kristalle einwirken ließen. Normalerweise zerstört die längere Einwirkung von Röntgenstrahlung die darin enthaltenen Proteine und Nukleinsäuren, weil sie zur Bildung von freien Elektronen und Radikalen führt. Hier jedoch bewirkte ihre Einwirkung auf die Photolyase/DNA-Kristalle unerwarteterweise eine Reparatur des CPD-Schadens bei einer Temperatur von 173 Grad Celsius unter Null. Offensichtlich konnten die durch Röntgenstrahlung freigesetzten Elektronen einem ähnlichen Weg folgen wie die durch blaues Licht im Enzym erzeugten Elektronen. Die Struktur zeigt demnach einen bei minus 173 Grad Celsius ausgefrorenen Zustand an, der bei Raumtemperatur nur wenige Nanosekunden nach dem Reparaturereignis vorliegt.
Künftige Ziele
Mit der Beschreibung dieser Struktur sind die seit einem Jahrzehnt währenden Spekulationen über den Mechanismus der ungewöhnlichen lichtgetriebenen Reparatur zu einem vorläufigen Abschluss gelangt. Nun haben sich die Marburger und Münchner Arbeitsgruppen weitere Ziele gesteckt. Zum einen gibt es weitere tierische und pflanzliche Klassen von Photolyasen, die sich im Aufbau ihrer aktiven Zentren unterscheiden. Zum anderen haben ein weiteres Viertel von UV-vermittelten DNA-Schäden eine andere chemische Struktur als die CPD-Schäden, werden aber über eine ähnliche lichtgetriebene Katalyse aufgelöst. Auch hier gilt es, die strukturellen Grundlagen für den Reparaturmechanismus aufzuklären.
Im Rahmen künftiger Arbeiten streben die Forscher aber auch eine gezielte Veränderung dieser Enzyme an. Chemiker beispielsweise könnten die Katalyse durch Lichtenergie auch für die Umwandlung anderer Substrate einsetzen und dabei möglicherweise auch anderes als blaues Licht verwenden. In Mausexperimenten wurde zudem bereits gezeigt, dass der durch Photolyasen vermittelte Reparaturprozess zu erhöhter UV-Resistenz führen kann, selbst an „aktiver Sonnencreme“, die Strahlungsschäden bei Menschen unmittelbar reparieren soll, wird geforscht.
Beim Menschen allerdings kommen Photolyasen nicht vor. Bei ihm wie bei anderen plazentalen Säugetieren wie Mäusen und Pferden hat die Evolution auf den effektiven Reparaturmechanismus der Photolyasen zugunsten anderer Reparatursysteme „verzichtet“. Im Jahr 2002 jedoch konnte die Arbeitsgruppe von Dr. Gijsbertus van der Horst (Universität Rotterdam) an transgenen Mäusen zeigen, dass die Einführung von Photolyase-Genen die Tiere dennoch wesentlich resistenter gegen ultraviolette Strahlung machte. Tierisches Leben auf Planeten ohne schützende Ozonhülle wie zum Beispiel dem Mars wäre demnach prinzipiell möglich, wenn die Photolyasen ihre schützende Wirkung voll entfalten können.
Weitere Informationen
Professor Dr. Lars-O. Essen: Fachbereich Chemie der Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg, Tel.: (06421) 28 22032, E-Mail: essen@chemie.uni-marburg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…