Die Natur erfindet das Rad nur einmal
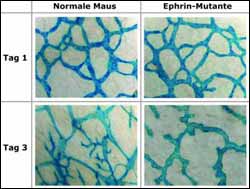
Ephrine regulieren die Entwicklung der Lymphgefäße in der Haut. Die Abbildung zeigt ein normales Lymphgefässsystem an Tag1 nach der Geburt (obere Bildreihe) und am Tag 3 nach der Geburt (Bildreihe unten). Die Bilder in der linken Spalte (oben Tag 1, unten Tag 3 nach der Geburt) zeigen Lymphgefäße einer sich normal entwickelnden Maus. In der rechten Spalte (oben Tag 1, unten Tag 3 nach der Geburt) sind Aufnahmen der Lymphgefäße der ephrinB2 Mutante zu sehen. Das Fehlen von kapillaren Aussprossungen in der ephrinB2-Mutante an Tag 3 sind im rechten unteren Foto klar zu erkennen. Bild: Max-Planck-Institut für Neurobiologie
Gene und Proteine, die Nerven wachsen lassen, steuern auch Blut- und Lymphgefäße, berichten Forscher des Max-Planck-Instituts für Neurobiologie in Martinsried
Während der Entwicklung eines Lebewesens bilden sich aus einzelnen Zellen spezialisierte Gewebe und Systeme. Dazu müssen die Zellen Informationen erhalten, wo sie im Körper später ihre Funktionen ausüben und mit welchen Zellen sie ein gemeinsames Netzwerk oder Gefäßsystem bilden sollen. Das erfolgt über ein ausgeklügeltes Signalsystem, dessen Funktionen man bisher hauptsächlich im Nervensystem studiert hatte. Inzwischen mehren sich Hinweise, dass die Gene und Proteine, die das Verkabeln von Nervenzellen regulieren, auch Blutgefäße dirigieren. Einen weiteren Baustein dazu liefern jetzt Wissenschaftler des Max-Planck-Instituts für Neurobiologie: Sie zeigen erstmals, dass die Entwicklung des Lymphgefäßsystems verschiedene Phasen durchläuft und seine Verzweigung nach ähnlichen Prinzipien erfolgt wie die Verästelung feiner Nervenfortsätze. Die Natur setzt offensichtlich gut funktionierende Signalsysteme mehrfach ein. Das Signal-Protein EphrinB2, das maßgeblich an der Lenkung von Nervenfortsätzen beteiligt ist, ist auch essentiell für die Ausbildung eines funktionierenden Lymphgefäßsystems (Genes & Development, 1. Februar 2005).
Zellen, die am Aufbau von Blutgefäßen und Nerven-Netzwerken beteiligt sind, müssen miteinander in Kontakt treten, um sich zu vernetzen oder ihren Weg zu finden. Dazu bilden die Zellen während ihres Wachstums unterschiedliche Fortsätze aus, die durch verschiedene Faktoren gesteuert werden. Nervenzellen bilden so genannte Axone, an deren Spitze sich ein Wachstumskegel befindet, der die Umgebung nach Signalen ertastet. Vom Wachstumskegel gehen fingerförmige Fortsätze (Filopodien) aus, die mit Empfänger-Proteinen für chemische Signale besetzt sind.
Die Max-Planck-Wissenschaftler um Rüdiger Klein haben sich auf die „Sender-Proteine“ (Ephrine) und die „Empfänger-Proteine“ (Eph-Rezeptoren) spezialisiert. Über eine Verankerung in der Zellmembran sitzen diese Proteine fest auf der Oberfläche oder in der Zellmembran der Zellen, die sich begegnen. Jeweils ein Ephrin-Ligand der „Weg-suchenden“ Zelle kann mit einem Eph-Rezeptor einer „Weg-weisenden“ Zelle binden oder umgekehrt. Sie bilden einen so genannten Ephrin/Eph-Komplex, eine feste Verbindung, über die das Rezeptorprotein – wie eine Antenne – ein Signal in das Innere jener Zelle weitergibt, auf der es sitzt. Dadurch werden zelluläre Prozesse ausgelöst, die schließlich dazu führen, dass sich die Zellen oder ihre Fortsätze entweder abstoßen oder anziehen. Abstoßung und Anziehung sind also Voraussetzung dafür, dass die richtigen Zellen zueinander finden.
Bereits in den späten 1990er Jahren hatten Wissenschaftler um Rüdiger Klein, damals noch am European Molecular Biology Laboratory (EMBL) in Heidelberg, erste Gemeinsamkeiten zwischen der Lenkung von Nervenfortsätzen und der Blutgefäßentwicklung entdeckt. Zeitgleich mit David Anderson’s Arbeitsgruppe am Caltech in Kalifornien zeigte Rüdiger Klein’s Team, dass EphrinB2 von Arterien gebildet wird, nicht aber von Venen, und dass EphrinB2 essentiell für die Ausbildung eines funktionierenden Blutgefäßsystems ist. Während der Entwicklung des embryonalen Blutgefäßsystems kommt es zu umfangreichen Umgestaltungen – neue Kapillaren sprossen ins Gewebe aus, andere werden wiederum abgebaut. EphrinB2 reguliert die Neubildung und das Wachstum von Kapillaren, ähnlich wie Nervenfortsätze im Gehirn.
In ihrer neuesten Arbeit haben Taija Mäkinen, George Wilkinson und Rüdiger Klein nun entdeckt, dass Lymphgefäße gleichartigen Umgestaltungsprozessen unterworfen sind, wie man sie bereits bei Blutgefäßen kennt. Einzelne Zellen, die die Gefäße auskleiden, so genannte Endothelzellen, lösen sich aus dem Zellverband und bilden – ähnlich wie die neuronalen Wachstumskegel bei Axonen – lange Filopodien, mit denen sie offensichtlich chemische Signale aus der Umgebung ertasten. Die Filopodien-tragenden Zellen sind die treibende Kraft, neue Lymphkapillaren zu bilden. Ephrine und Eph-Rezeptoren sind auch an der Umgestaltung von Lymphgefäßen im Hautgewebe von Mäusen beteiligt und kontrollieren dadurch den Transport der Lymphe zurück in den Blutkreislauf.
Rüdiger Kleins Team hat in Zusammenarbeit mit Wissenschaftlern aus Finnland, USA, Großbritannien und der Schweiz die Entwicklung von Mäusen untersucht, bei denen das Gen für die korrekte Struktur von EphrinB2 verändert wurde (knock-in Mäuse). Wurde eine fehlerhafte Form von EphrinB2 gebildet, zeigten die Mäuse ein stark verringertes Lymphkapillarsystem der Haut, Aufblähungen der großen Lymphgefäße mit Fehlbildungen in den Gefäßklappen und Rückstau von Lymphe im Brustkorb. Die Lebensfähigkeit dieser Mäuse war dadurch stark eingeschränkt. Da die Forscher verschiedene knock-in Mäuse untersucht hatten, konnten sie auch feststellen, welche Merkmale des Ephrin-Proteins unbedingt vorhanden sein mussten, damit die Signalwege und damit auch die Gefäße korrekt ausgebildet werden.
Die Entdeckung, dass auch das Lymphgefäßsystem durch Ephrine umfangreichen Umgestaltungen unterworfen wird, ist ein weiteres Beispiel, wie Blut- und Lymphgefäßsysteme Mechanismen kopiert haben, die sich bereits erfolgreich bei der Vernetzung von Nervenzellen entwickelt hatten. Mit anderen Worten: Die Natur setzt bewährte Systeme mehrfach ein und hat nicht für jeden Entwicklungsbereich das Rad neu erfunden.
Originalveröffentlichung:
Taija Mäkinen, Ralf H. Adams, John Bailey, Qiang Lu, Andrew Ziemiecki, Kari Alitalo, Rüdiger Klein, and George A. Wilkinson
PDZ interaction site in ephrinB2 is required for the remodeling of lymphatic vasculature
Genes & Development. 2005 19: 397-410
Media Contact
Weitere Informationen:
http://www.neuro.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















