Herpesvirus in 3D
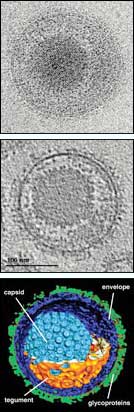
Tomographische Rekonstruktion eines Herpes-Virions im schockgefrorenen (vitrifizierten) Zustand: Oben die Architektur des Herpes simplex Virus 1, wie sie sich im Elektronenmikroskop zeigt, in der Mitte ein Schnitt durch das rekonstruierte und entrauschte Tomogramm und unten die detaillierte 3D-Struktur des Herpes-Virions nach der Segmentierung seiner Hauptbestandteile aus dem Elektronentomogramm. Alle Teilabbildungen sind im selben Maßstab. <br> <br>Bild: Kay Grünewald, Max-Planck-Institut für Biochemie/NIH <br>
Einem Forscherteam von NIH und MPI für Biochemie ist es gelungen, den äußeren Aufbau des Virus mittels Kryo-Elektronentomographie sichtbar zu machen
Viele Viren sind strukturell sehr komplexe, aus Tausenden von Einzelmolekülen bestehende Gebilde. Ein wichtiger Vertreter ist das Herpesvirus, von dem mehr als 90 Prozent der Weltbevölkerung durchseucht sind. Aufgrund der meist asymmetrischen Form von Viren war es bisher nicht möglich, die molekulare Architektur ihrer für die Infektion von Zellen sehr wichtigen äußeren Schichten aufzuklären. Jetzt ist es Forschern um Alasdair Steven vom National Institute of Arthritis, Musculoskeletal and Skin Diseases an den National Institutes of Health (NIH) sowie Wolfgang Baumeister vom Martinsrieder Max-Planck-Institut für Biochemie erstmals gelungen, diese äußeren Bereiche bei infektiösen Partikeln des Herpesvirus sichtbar zu machen. Die Partikel enthalten offenbar Hunderte von winzigen Fortsätzen („Spikes“), die in unterschiedlicher Länge und Form aus der äußeren Membran herausragen, und deren Anordnung auf der Membran nicht zufällig, sondern sehr funktional erscheint (Science, 21. November 2003). Dieser Erfolg gelang mit Hilfe der Kryo-Elektronentomographie, einer Technik, die am Max-Planck-Institut für Biochemie entwickelt und im Jahr 2002 erstmals erfolgreich für eukaryotische Zellen eingesetzt wurde.
Bei Herpes-simplex-Virus vom Typ 1 handelt es sich um einen komplexen, nur 180 bis 220 Nanometer großen DNA-Virus. Seine als „Virion“ bezeichneten infektiösen Partikel bestehen aus Tausenden von Einzelmolekülen. Ihre DNA wird von einer als „Capsid“ bezeichneten Proteinhülle beherbergt, deren Struktur aufgrund ihrer ikosaedrischen Symmetrie schon frühzeitig mittels Kryo-Elektronenmikroskopie aufgeklärt werden konnte. Im Gegensatz dazu war bisher über den Aufbau der asymmetrischen, das Capsid umgebenden äußeren Schichten des Virions, insbesondere aber über das „Tegument“ genannte proteinreiche Kompartiment sowie die mit Glycoproteinen reich besetzte Hüllmembran fast nichts bekannt. Mittels Kryo-Elektronentomographie gelang es den NIH- und Max-Planck-Wissenschaftlern nun, diese Strukturen, die eine wichtige Rolle bei der zellulären Infektion spielen, zu untersuchen.
Die Elektronen-Tomographie ist eine Technik ähnlich der bekannten Magnet-Resonanz-Tomographie. Dazu werden die Untersuchungsobjekte im Elektronenmikroskop schrittweise um eine Achse rechtwinklig zum Elektronenstrahl gedreht und entsprechende Projektionsbilder aufgenommen. Aus 80 bis100 dieser Bilder kann dann ein dreidimensionales Abbild errechnet werden. Durch die Kombination dieser Methode mit Gefriertechniken, bei denen die Probe schnell – ohne dass sich kristallines Eis bilden kann – eingefroren wird, lassen sich biologische Objekte in ihrem natürlichen Zustand mit hoher Auflösung untersuchen. Die Arbeitsgruppe um Prof. Wolfgang Baumeister am Max-Planck-Institut für Biochemie in Martinsried hat eine Pionierrolle bei dieser Technik, die sich speziell für die Analyse komplexer asymmetrischer Proben eignet. So gelang es Baumeister und seinen Mitarbeitern im Jahr 2002 erstmals, die makromolekulare Architektur eukaryotischer Zellen mit Hilfe der Elektronentomographie darzustellen.
In der Regel ist es schwierig zu bestimmen, welche Auflösung man mit den Tomogrammen erreicht hat, da auf Strukturvergleichen beruhende Kriterien wegen der Individualität der Objekte nicht anwendbar sind. Die untersuchten Virionen des Herpesvirus verfügen jedoch mit dem strukturell bereits gut charakterisierten Capsid über ein wiederkehrendes Motiv, eine Art internen Standard, den die Wissenschaftler zur objektiven Einschätzung der erreichten Auflösung (etwa 6-7 Nanometer) heranziehen konnten.
Das deutsch-amerikanische Forscherteam fand nun heraus, dass das Tegument, das etwa zwei Drittel des Membran-umschlossenen Volumens des Partikels einnimmt, eine asymmetrische Kappe bildet. Diese formt an einer Seite eine etwa 35 Nanometer dicke Schicht zwischen Capsid und Membranhülle, während das Capsid an der gegenüber liegenden Seite in direktem Kontakt mit der Membran steht. Das Capsid hat folglich bei den Herpes-Partikeln eine exzentrische Position und ist mit dem Tegument an den Ecken des Ikosaeders verbunden. Die Feinstruktur des Teguments erscheint bei der derzeitigen Auflösung von 6 bis 7 Nanometern als ein dichtes partikuläres Netzwerk. Auffällig ist hierbei das Auftreten von etwa 7 Nanometer breiten und bis zu 40 Nanometer langen, fädigen Strukturen – wahrscheinlich Aktinfilamenten.
In der Hüllmembran des Herpesvirus kennt man etwa elf verschiedene Glycoproteine. In den neuen tomographischen Aufnahmen ist nun zu sehen, dass diese als Fortsätze (Spikes) unterschiedlicher Form und Länge aus der Membran herausragen und mit dem Tegument über nur etwa vier Nanometer breite Strukturen verbunden sind. Die Verteilung der circa 650 Spikes auf der Membran lässt zudem auf eine funktionale Clusterung der Glycoproteine schließen. Diese Beobachtungen helfen zu verstehen, welche Rolle Tegument und Hüllmembran bei der Virus-Infektion von Zellen spielen.
„Die Kryo-Elektronentomographie erscheint uns als ein sehr geeignetes Mittel, um Virus-Wirts-Interaktionen auf molekularer Ebene einschließlich der Mechanismen aufklären zu können, über die das Virus in Zellen hinein- und wieder hinausgelangt,“ stellt Kay Grünewald, Erstautor der Studie und Emmy-Noether-Stipendiat der DFG, fest. „Darüber hinaus zeigen unsere Ergebnisse, welches Potential diese Methode hat, um bei der Analyse der molekularen Architektur weiterer asymmetrischer, medizinisch hoch relevanter Erreger wie HIV oder dem Vaccinia-Virus voranzukommen.“
Hintergrundinformation: Kryo-Elektronenmikroskopie
Elektronentomographie ist eine Spezialform der Elektronenmikroskopie. Sie ermöglicht es auch, die dreidimensionale Struktur von biologischen Objekte zu untersuchen, die den üblichen, auf Mittelung von Einzelpartikeln beruhenden, so genannten „single particle“ Techniken der Bildprozessierung, nicht zugänglich sind. Bedingt durch rasche Fortschritte in der Computertechnik und insbesondere in der Bildverarbeitung erlebt die Elektronentomographie eine eindrucksvolle Entwicklung. So erlaubt die elektronentomographische Analyse von Dünnschnitten kryofixierter, gefriersubstituierter und in Kunstharz eingebetteter biologischer Objekte neue Einblicke in die Zellorganisation bis hin zu den einzelnen Organellen. Allerdings werden die Objekte dabei im nicht hydratisierten Zustand und nach Kontrastierung mit Schwermetallsalzen untersucht, was die Aussagekraft der Ergebnisse bei makromolekularen Strukturen begrenzt.
Seit der Einführung der Kryotechniken in die Elektronenmikroskopie um 1984 ist es möglich, Strukturen in ihrer nativen wässrigen Umgebung im schockgefrorenen (vitrifizierten) Zustand elektronenmikroskopisch zu untersuchen. Die Einbettung in vitrifiziertes Eis garantiert dabei nahezu native Strukturen und minimale Beeinträchtigung ihres physiologischen Zustandes und ermöglicht Untersuchungen bis in den Bereich makromolekularer Strukturen. Automatisierungsverfahren bei der Datenaufnahme und die damit verbundene geringere effektive Elektronendosis ermöglichten es in den letzten zehn Jahren, strahlungsempfindliche Objekte wie vitrifizierte Zellen, Organellen und größere supramolekulare Komplexe im hydratisierten Zustand elektronentomographisch zu untersuchen (Kryo-Elektronentomographie).
Die beobachteten makromolekularen Strukturen können dann hinsichtlich ihrer Verteilung im Objekt untersucht und mittels multivarianter Statistik in verschiedene Klassen, wie zum Beispiel in verschiedene Funktionszustände oder Konformationen, untergliedert werden. Außerdem besteht bei entsprechenden Auflösungen die Möglichkeit, Strukturmodelle hoher Auflösung aus Röntgenkristallographie, NMR-Spektroskopie, 2D-Elektronenkristallographie und „single particle“-Analyse in die elektronentomographisch gewonnenen Strukturen einzupassen und so zusätzliche Hinweise auf Veränderungen zu erhalten. Kryo-Elektronentomographie ist damit ein wichtiges Bindeglied bei der umfassenden Analyse der vielfältigen Interaktionen molekularer Einheiten („structural proteomics“) und der Aufklärung der allgemeinen, den zellulären Prozessen zugrunde liegenden strukturellen Prinzipien.
Originalveröffentlichung:
Kay Grünewald, Prahant Desai, Dennis C. Winkler, J. Bernhard Heymann, David M. Belnap, Wolfgang Baumeister, Alasdair C. Steven, „Three-Dimensional Structure of Herpes Simplex Virus from Cryo-Electron Tomography“, Science, 21 November 2003
Weitere Informationen erhalten Sie von:
Dr. Kay Grünewald (NIH und Max-Planck-Institut für Biochemie)
Laboratory of Structural Biology Research, NIAMS, NIH, Bethesda/USA
Tel.: 089-8578-2645, Fax: -2641
E-Mail: gruenewa@biochem.mpg.de
Prof. Dr. Wolfgang Baumeister
Max-Planck-Institut für Biochemie, Martinsried
Tel.: 089-8578-2652, Fax: -2641
E-Mail: baumeist@biochem.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















