Flüchtige Begegnungen mit Fingerhakeln
Eine Nervenzelle (unten) stößt auf eine (HeLa-)Krebszelle (oben) mit fluoreszierenden EphB-Rezeptoren. In der Abbildung handelt es sich um normalen EphB-Rezeptor.
Max-Planck-Neurobiologen beobachten erstmals, wie die Wegfindung von Zellen während der Entwicklung des Nervensystems durch Endocytose erleichtert wird
Wächst und entwickelt sich ein Lebewesen, müssen seine Zellen zu den unterschiedlichsten Bestimmungsorten wandern, um dort Teil eines Gewebes oder Organs zu werden. Ihre Wegweiser sind dabei andere Zellen, die mit ihnen Kontakt aufnehmen und sie nach kurzer Bindung wieder von sich wegstoßen. Den Kontakt knüpfen die Zellen mit Hilfe von speziellen Proteinen, den Ephrin-Liganden und den Eph-Rezeptoren, die in der Zellmembran verankert sind. Wissenschaftler des Max-Planck-Instituts für Neurobiologie in Martinsried bei München haben jetzt entdeckt, dass die dabei entstehenden Proteinkomplexe sowohl von der „wegsuchenden“ als auch von der „wegweisenden“ Zelle durch Endocytose aufgenommen und dann abgebaut werden können, so dass sich die wandernde Zelle zurückziehen und neu orientieren kann. Damit wurde erstmals nachgewiesen, dass Endocytose auch im Zusammenhang mit der Zellwanderung und der Entwicklung des Nervensystems auftritt. Diese Erkenntnisse sind von grundlegender Bedeutung für das Verständnis der komplexen Wechselwirkungen zwischen biologischen Zellen während der Entwicklung eines Organismus (Nature Cell Biology 5 (10): 869 878, October 2003).
Nervenzellen entwickeln während ihres Wachstums einen langen Fortsatz (Axon) sowie mehrere kurze fein verzweigte Fortsätze (Dendriten). Das Axon selbst wiederum bildet einen Wachstumskegel mit fußartigen und fühlerartigen Ausläufern (Lamellipodien und Filipodien) aus, mit deren Hilfe sich die Nervenzelle ihren Weg durch das Gewebe bahnt bzw. mit anderen Nervenzellen zu einem Nervensystem verbindet. Andere Zellen, mit denen die wandernde Zelle in Berührung kommt, weisen ihr dabei den Weg, indem sie kurz an die Nervenzelle binden und diese dann wieder abstoßen. Dadurch fällt der Wachstumskegel des Axons in sich zusammen, die Lamellipodien und Filipodien ziehen sich zurück und nach einer Regenerierungsphase sucht sich das Axon einen neuen Weg (vgl. Video).
Video:
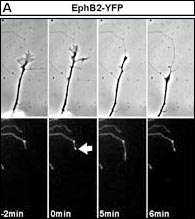
In der oberen Bildschirmhälfte sind Phasenkontrastaufnahmen des Axons einer kultivierten neuronalen Zelle aus dem Kortex embryonaler Mäuse zu sehen. Der Wachstumskegel des Axons steht kurz vor dem Kontakt mit einer HeLa-Zelle (oben rechts). Deutlich zu sehen sind die Filopodien und Lamellipodien des Axons. Die HeLa-Zelle besitzt einen fluoreszenzmarkierten Rezeptor. Dieser ist in der unteren Bildschirmhälfte zu sehen. Sobald der Wachstumskegel in Kontakt mit den Fortsätzen der HeLa-Zelle tritt, bilden sich Komplexe, die der EphB2-Rezeptor mit EphrinB-Liganden der neuronalen Zelle bildet. EphrinB-Liganden induzieren Signaltransduktionskaskaden, die dazu führen, dass der Wachstumskegel kollabiert und der gesamte Axon sich zurückzieht. Dabei werden die Fortsätze der HeLa-Zelle herausgezogen. Sie bleiben förmlich am kollabierenden Wachstumskegel solange kleben, bis der Kontakt mittels Endocytose aufgehoben werden kann. Dies ist deutlich daran zu sehen, wie kontinuierlich fluoreszierende Komplexe vom Wachstumskegel aufgenommen werden. Am Ende des Films sieht man, wie sich der Wachstumskegel neu formiert.
Wissenschaftler am Max-Planck-Institut für Neurobiologie in Martinsried untersuchen, mit welchen Mechanismen Nervenzellen untereinander Kontakt aufnehmen. Im Zentrum ihrer Forschung stehen dabei zwei spezielle Protein-Gruppen, die Ephrin-Liganden und die Eph-Rezeptoren, die wie ein Schlüssel zu seinem Schloss ineinander passen. Über eine Verankerung in der Zellmembran sitzen diese Proteine fest auf der Oberfläche der Zellen, die sich begegnen. Jeweils ein Ephrin-Ligand der „wegsuchenden“ Zelle kann mit einem Eph-Rezeptor einer „wegweisenden“ Zelle binden oder umgekehrt. Sie bilden einen so genannten Ephrin/Eph-Komplex, eine feste Verbindung, über die das Rezeptorprotein – wie eine Antenne – ein Signal in das Innere der Zelle weitergibt, auf der es sitzt. Dadurch werden zelluläre Prozesse ausgelöst, die schließlich zur Abstoßung der beiden Zellen voneinander führen. Die endgültige Trennung der Zellen wird dann durch das Auflösen des Ephrin/Eph-Komplexes ausgelöst.
Die Wissenschaftler Manuel Zimmer, Amparo Palmer und Jenny Köhler haben nun unter Leitung von Rüdiger Klein entdeckt, dass die Aufnahme des Ephrin/Eph-Komplexes durch Endocytose erst die Voraussetzung für die Abstoßung der Zellen bildet. Endocytose ist ein Vorgang, mit dem Zellen gelöste Proteine, Partikel aus ihrer Umgebung in Membranen einschließen und in sich aufnehmen. Doch dass Proteine, die in einer Zellmembran verankert sind, durch die Komplexbildung mit anderen Proteinen aus der Membran gelöst und dann durch Endocytose in beide Nachbarzellen einverleibt werden können, ist völlig neu.
Zimmer und seine Kollegen konnten bei ihren Experimenten, die sie mit Zellkulturen von Nerven-, Bindegewebs- und Krebszellen (HeLa-Zellen) durchführten, zeigen, dass die Endocytose in beide Richtungen erfolgen kann und sowohl in den „wegsuchenden“ also auch in den „wegweisenden“ Zellen Signalketten im Innern auslöst. Dabei sorgt die vorwärts gerichtete Endocytose (in die Zelle, die den Rezeptor bildet) bei Kontakten zwischen Nervenzellen für die Ablösung des Axons von der wegweisenden Zelle und den Rückzug der Lamellipodien. Die rückwärts gerichtete Endocytose (in die Zelle, die den Liganden bildet) dagegen bewirkt, dass der Wachstumskegel des Axons selbst in sich zusammenfällt (Kollaps). Welche der beiden Endocytose-Arten überwiegt, hängt von verschiedenen Bedingungen der Umgebung ab, jedoch sind für eine effiziente Abstoßung offensichtlich beide Arten der Endocytose wichtig.
Die Martinsrieder Max-Planck-Forscher dokumentierten ihre Beobachtungen unter dem Mikroskop mit mehrstündigen Videoaufnahmen. Dazu hatten sie die Ephrin-Liganden und Eph-Rezeptoren mit fluoreszierenden Proteinen markiert und konnten so die Endocytose direkt verfolgen. Gleichzeitig filmten sie die Kontaktaufnahme der Zellen im Phasenkontrastlicht. Auf diese Weise konnten die Wissenschaftler parallel sowohl die ganzen Zellen als auch das Schicksal ihrer Ephrin/Eph-Rezeptoren genau verfolgen. Die Abbildung zeigt eine Nervenzelle, die mit einer HeLa-Zelle in Kontakt kommt, deren Fortsatz zunächst weit gestreckt wird und dann zusammenbricht. Im Film ist der Kontakt zwischen HeLa-Zellen zu sehen und im fluoreszierenden Bild die Aufnahme des Ephrin/Eph-Komplexes.
Mit ihren Ergebnissen haben Zimmer, Palmer, Köhler und Klein einen wichtigen Beitrag geleistet zum Verständnis der Zell-Zell-Kontakte und ihrer Funktion bei der Wanderung von Zellen während der Entwicklung eines Organismus. „Mit diesen Zeitrafferaufnahmen erreichen wir eine neue Ebene der Analyse, die uns bei zukünftigen entwicklungsbiologischen Untersuchungen sehr hilfreich sein wird“, sagt Rüdiger Klein.
Weitere Informationen erhalten Sie von:
Eva-Maria Diehl (Öffentlichkeitsarbeit)
Max-Planck-Institut für Neurobiologie, Martinsried b. München
Tel.: 089-8578-2824
Fax.: 089-8578-2943
E-Mail: diehl@neuro.mpg.de
Media Contact
Weitere Informationen:
http://www.neuro.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue Industrie-4.0-Lösung für niedrigschwelligen Zugang zu Datenräumen
»Energizing a Sustainable Industry« – das Motto der Hannover Messe 2024 zeigt klar, wie wichtig eine gleichermaßen leistungsstarke und nachhaltige Industrie für den Fertigungsstandort Deutschland ist. Auf der Weltleitmesse der…

Quantenpräzision: Eine neue Art von Widerstand
Physikforschende der Universität Würzburg haben eine Methode entwickelt, die die Leistung von Quantenwiderstands-Normalen verbessern kann. Sie basiert auf einem Quantenphänomen namens anomaler Quanten-Hall-Effekt. In der industriellen Produktion oder in der…

Sicherheitslücke in Browser-Schnittstelle erlaubt Rechnerzugriff über Grafikkarte
Forschende der TU Graz waren über die Browser-Schnittstelle WebGPU mit drei verschiedenen Seitenkanal-Angriffen auf Grafikkarten erfolgreich. Die Angriffe gingen schnell genug, um bei normalem Surfverhalten zu gelingen. Moderne Websites stellen…