Vorratshaltung sorgt für Geschwindigkeit – Dynamische Prozesse bei der Signalübertragung im Gehirn
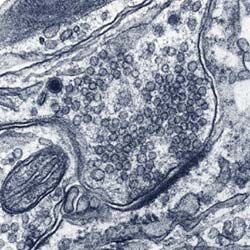
Elektronenmikroskopische Aufnahme einer Synapse zwischen hippokampalen Zellen in Kultur. Der "Vorrat" an synaptischen Vesikeln ist deutlich zu sehen. (Abb: Jürgen Klingauf, Max-Planck-Institut für biophysikalische Chemie)
Wenn Nervenzellen miteinander kommunizieren, verwenden sie eine Kombination von elektrischen und chemischen Signalen: Elektrische Spannungsänderungen an der einen Zelle führen dazu, dass chemische Botenstoffe freigesetzt werden, die bei der nachfolgenden Zelle wieder ein elektrisches Signal auslösen. Wie dies möglichst schnell geschehen kann und wie sich die Abläufe der Signalverarbeitung den aktuellen Anforderungen anpassen können, ist seit vielen Jahren Gegenstand der Forschung. Untersuchungen aus zwei Arbeitsgruppen um den Nobelpreisträger Erwin Neher am Max-Planck-Institut für biophysikalische Chemie in Göttingen haben jetzt weitere Einzelheiten der synaptischen Übertragung entschlüsselt. (T. Sakaba & E. Neher, Nature 424, 775-778, 2003, und J. Soerensen et al., Cell 114, 75-86, 2003).
Elektronenmikroskopische Aufnahme einer Synapse zwischen hippokampalen Zellen in Kultur. Der „Vorrat“ an synaptischen Vesikeln ist deutlich zu sehen. (Abb: Jürgen Klingauf, Max-Planck-Institut für biophysikalische Chemie)
Die Kommunikation zwischen Nervenzellen ist die Voraussetzung für Wahrnehmung, Denken und Handeln. Eine der größten Herausforderungen für das Zentralnervensystem aller Lebewesen ist es dabei, möglichst schnell zu reagieren. Dies ermöglicht schnelle Schutzreflexe und letztendlich auch den Ablauf gedanklicher Prozesse innerhalb tolerierbarer Zeit. Um Signale über größere Abstände schnell zu vermitteln, hat die Natur elektrische Signalmechanismen entwickelt. Für die Weiterleitung des Signals auf nachgeschaltete Zellen und auch für die Interaktion zwischen den Milliarden von Nervenzellen in unserem Gehirn bedient sie sich allerdings weitgehend einer chemischen Signalübertragung. Dies geschieht an den so genannten Synapsen. Dort gibt die prä-(vor-)synaptische Nervenendigung einen Botenstoff ab, der in den Zwischenraum zwischen den Zellen eindringt und in der postsynaptischen (nachgeschalteten) Zelle Ionenkanäle öffnet, die wiederum ein elektrisches Signal auslösen. Warum so kompliziert, wenn doch Geschwindigkeit ein wesentlicher Faktor ist? Und wie schaffen es die Nervenzellen, dass dieser Prozess trotzdem einigermaßen schnell abläuft?
Nach der Meinung vieler Neurobiologen ermöglicht gerade dieser komplizierte Ablauf die besonderen Leistungen des Gehirns. Dadurch, dass die Verbindungen zwischen den einzelnen Nervenzellen nicht starr sind, sondern sich ständig plastisch verändern, kann sich in den Schaltkreisen unseres Zentralnervensystems Gedächtnis entwickeln und können sich Verbindungen aufgrund von Sinneseindrücken oder während gedanklicher Prozesse umorganisieren. Bestünde die Signalübertragung zwischen Nervenzellen nur in einer einfachen elektrischen Kopplung, so wäre dies nicht möglich.
Botenstoffe auf Vorrat
Wie schaffen es Synapsen trotz dieser Umständlichkeit schnell und kontrolliert zu reagieren? Forschungsarbeiten der Abteilung Membranphysik am Max-Planck-Institut für biophysikalische Chemie, in Zusammenarbeit mit den Sonderforschungsbereichen 406 „Synaptische Interaktionen in neuronalen Zellverbänden“ und 523 „Protein- und Membrantransport zwischen zellulären Kompartimenten“ sowie mit dem neuen DFG Forschungszentrum „Molekularphysiologie des Gehirns“ (CMPB) haben darauf einige Antworten entwicklt. Die Synapsen bedienen sich eines Tricks: Der zur Signalübertragung notwendige Botenstoff (Neurotransmitter) wird, in so genannten Vesikeln verpackt, auf Vorrat gehalten. Jede Nervenendigung enthält eine Vielzahl solcher synaptischer Vesikel, die bei Ankunft eines Nervenimpulses mit der Membran der Nervenfaser verschmelzen und ihren Inhalt ausschütten.
Kalzium als Auslöser
Drei Forschergruppen um Prof. Neher konnten in den letzten Jahren Teilfragen dieser komplexen Regulationsmechanismen klären. Während in anderen Zelltypen vielerlei Substanzen in Vesikeln verpackt, an den Rand der Zelle transportiert und dort irgendwann freigesetzt werden, erfolgt die Freisetzung von Neurotransmittern aus Nervenzellen zeitlich kontrolliert. Transmitterbeladene Vesikel verharren dort an der Zellmembran, bis ein Nervenimpuls das Signal zur Freisetzung gibt. Seit etwa 50 Jahren ist bekannt, dass ein Anstieg der intrazellulären Kalziumkonzentration der unmittelbare Auslöser für die Freisetzung ist. Bis vor kurzem wusste man allerdings nicht, wie hoch die Kalziumkonzentration ansteigen muss. In Untersuchungen an einer speziellen Synapse im Hirnstamm von Ratten wurden vor einigen Jahren Abschätzungen erarbeitet, sowohl über die Größe als auch den Zeitverlauf dieser Abhängigkeit (Schneggenburger & Neher, 2000). Die Wissenschaftler haben dabei festgestellt, dass am Ort der Freisetzung ein sehr lokaler Kalziumanstieg um den Faktor 100 und mehr stattfindet, der allerdings nur eine halbe Millisekunde andauert. Offensichtlich bilden sich beim Öffnen von Kalziumkanälen in deren Nachbarschaft eng umgenzte Bereiche hoher Kalziumkonzentration aus, die nach dem Schließen der Kanäle sofort wieder verschwinden und somit ein schnelles An- und Abschalten der synaptischen Übertragung ermöglichen. Eine quantitative Beschreibung dieser Prozesse ist wichtig für die Beantwortung weiterführender Fragen in Bezug auf kurzzeitige „plastische“ Veränderungen der Synapsenstärke bei wiederholter Reizung und über die molekulare Natur des Proteins, welches die Kalziumkonzentration in der Zelle misst und die Reaktion auslöst.
Molekulare Akteure
Ein zweiter Arbeitsansatz konzentrierte sich auf die molekularen Akteure des Freisetzungsprozesses. Jüngste Untersuchungen haben ergeben, dass sich nach der Anlagerung eines Vesikels an die Zellmembran ein so genannter „SNARE“-Komplex bildet. Dieser besteht aus Molekülen, von denen einige (SNAP25 und Syntaxin) in der Zellmembran verankert sind und ein weiteres (Synaptobrevin) in der Vesikelmembran. Durch die Bildung des Komplexes werden die beiden Strukturen aneinandergeheftet. Ähnliche Reaktionen finden in vielen Zelltypen und dort auch an vielen Stellen statt. Wo immer innerhalb der Zelle Membranstrukturen fusionieren, sind sehr ähnliche Moleküle wirksam, so zum Beispiel in den Zellbestandteilen endoplasmatisches Retikulum, im Golgiapparat und an den Endosomen. Das Besondere im Nervensystem ist, dass der Prozess offensichtlich nicht zur Vollendung gelangt, sondern in einem späten Stadium der Komplexbildung innehält und auf das auslösende Signal – den Kalziumanstieg – wartet. Dadurch entsteht ein „Vorrat“ an sekretionsbereiten Vesikeln, die, wann immer die Kalziumkonzentration ansteigt, innerhalb von Bruchteilen einer Tausendstelsekunde freigesetzt werden können. Um die Moleküle zu identifizieren, die für diese Vorratshaltung verantwortlich sind, haben die Wissenschaftler Untersuchungen an Nebennierenzellen durchgeführt, die im Stresszustand das Hormon Adrenalin ausschütten. Auch dieser Prozess funktioniert nach dem Prinzip der Vorratshaltung wie in Nervenzellen, hat aber den Vorteil, dass sich in den relevanten Zelltypen die beteiligten Moleküle leichter manipulieren lassen. Ausgangspunkt der Untersuchungen war ein Mäusestamm, in dem durch genetische Manipulation eine der Komponenten des SNARE-Komplexes, das Protein SNAP25, eliminiert ist. Aus den Nebennierenzellen dieser Mutante lassen sich Kulturen anlegen. Eine biophysikalische Analyse dieser Zellen ergab, wie erwartet, dass der Vorrat an sekretionsbereiten Speichervesikeln leer war; es war nur eine sehr langsam ablaufende Freisetzung (Sekretion) messbar. Behandelte man solche Zellen jedoch mit einem Virus, welcher die genetische Information für SNAP25 enthielt, so exprimierten die Zellen das Protein und erlangten gleichzeitig auch wieder ihre Sekretionsfähigkeit. Dies bestätigte, dass SNAP25 für die Sekretion essenziell ist.
Wie in den aktuellen Studien herauskam, spielt dieses Protein aber nicht nur beim Freisetzungsprozess aus Vesikeln eine Rolle, sondern reguliert auch maßgeblich die Frage der Vorratshaltung. Wurde das Experiment nämlich mit dem SNAP25-Typ durchgeführt, der in Neuronen vorkommt, so wurde ein großer Vorrat an sekretionsbereiten Vesikeln und dementsprechend eine schnelle Sekretion nach der Reizung beobachtet. Wurde dagegen eine Form des Proteins verwendet, die auch in vielen nicht-neuronalen Zellen vorkommt, so war zwar die Sekretionsfähigkeit der Zellen teilweise wieder hergestellt, interessanterweise jedoch war sie sehr langsam und zeigte keine Anzeichen von Vorratshaltung. Ebenso aufschlussreich war ein weiterer Befund: Ein Überschuss der allgemeinen („ubiquitären“) Form des Proteins bewirkte auch in Zellen von normalen Tieren den Verlust des Vorrats. Dies führte zu folgender Interpretation der molekularen Vorgänge: Bei der Bildung des SNARE-Komplexes lagern sich die Komponenten entsprechend ihrer Verfügbarkeit zusammen. Komplexe, welche die neuronale Form enthalten, besitzen die Eigenschaft, einen Vorrat zu bilden. Ist die ubiquitäre Form im Überschuss vorhanden, so verdrängt diese das neuronale SNAP25 und Vorratshaltung wird verhindert (Soerensen et al., 2003).
Regulierter Nachschub
Wie wird in diesem komplexen Gefüge molekularer Verbindungen synaptische Plastizität erzeugt? Eine der wichtigsten Formen der Kurzzeitplastizität ist die so genannte Kurzzeitdepression, die an vielen (aber nicht allen) Synapsentypen beobachtet werden kann. Sie besteht darin, dass bei repetitiver, schnell aufeinanderfolgender Reizung einer synaptischen Verbindung die Stärke des übertragenen Signals abnimmt. Dies kann viele Gründe haben; eine wichtige Ursache dafür ist das Aufbrauchen des Vorrats an Botenstoffen. Handelt es sich dabei um eine Unzulänglichkeit des Systems oder benutzt die Natur hier die vorhandenen Mechanismen der Regulation von Vesikeltransport zur Gestaltung der Kurzzeitplastizität? Für das letztere sprechen die aktuellen Befunde der Arbeitsgruppe, die zeigen, dass der „Vesikelnachschub“ ein hochregulierter Prozess ist. Bereits vor einigen Jahren hat die Gruppe gezeigt, dass die Wiederherstellung des Vorrats nach intensiver Reizung durch einen erhöhten Kalziumspiegel in der Zelle bechleunigt wird. Dieser Effekt wird durch das Protein Calmodulin vermittelt. Die neuesten Untersuchungen zeigten jetzt, dass neben Kalzium und Calmodulin auch eine gewisse Konzentration des Botenstoffes cAMP nötig ist, um die Beschleunigung des Nachschubs sicherzustellen. Im Normalzustand ist offensichtlich genügend cAMP vorhanden. Unter dem Einfluss eines zweiten, inhibitorischen Transmitters – z.B. Gamma-amino-Buttersäure (GABA) – wird der cAMP-Spiegel abgesenkt, was dann eine schnellere Entleerung des Vorrats und eine langsamere Wiederauffüllung bedingt (Sakaba & Neher, 2003). Dieses Zusammenwirken eines schnellen, erregenden Transmittersystems (Glutamat) mit einem langsamen, inhibitorischen Transmitter (GABA) eröffnet vielfältige Möglichkeiten einer komplexen Regulation synaptischer Verbindungsstärken. Herauszufinden, wie diese Regulation das Zusammenwirken einzelner Synapsen in Neuronenverbänden beeinflusst, ist jetzt das nächste Forschungsziel der Arbeitsgruppe.
Originalveröffentlichungen:
Sørensen, G. Nagy, F. Varoqueaux, R.B. Nehring, N. Brose, M.C. Wilson, and E. Neher: Differential control of the releasable vesicle pools by SNAP-25 splice variants and SNAP-23. Cell 114, 75-86 (2003).
Sakaba, T., and E. Neher: Direct modulation of synaptic vesicle priming by GABAB receptor activation at a glutamatergic synapse. Nature 424, 775-778 (2003).
Schneggenburger, R., and E. Neher: Intracellular calcium dependence of transmitter release rates at a fast central synapse. Nature 406, 889-893 (2000).
Weitere Informationen zur Thematik finden Sie in einem Artikel, den Prof. Neher vor kurzem in der Zeitschrift Georgia Augusta (2: 53-57, 2003) veröffentlicht hat.
Rückfragen bitte an:
Prof. Dr. Erwin Neher, Max-Planck-Institut für biophysikalische Chemie, Abteilung Membranbiophysik, Am Fassberg 11, 37077 Göttingen. Tel.: 0551-201 1630, Fax: 0551-201 1688, eMail: eneher@gwdg.de.
Media Contact
Weitere Informationen:
http://www.mpibpc.mpg.de/PR/03_11/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















