Das Tor zum Kraftwerk des Lebens
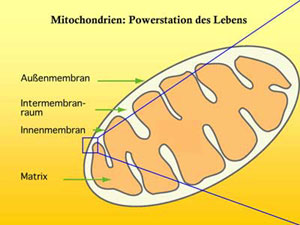
Abb. 1: Der Aufbau eines Mitochondriums. <br> <br>Grafik: Max-Planck-Institut für Biophysik <br>
Mitochondrien, die „Kraftwerke“ der Zellen, enthalten mehrere hundert verschiedene Proteine, von denen sie nur wenige selbst produzieren können. Alle anderen Proteine müssen auf komplizierten Wegen aus dem Zellinneren importiert werden. Auf welchem Weg dies geschieht, haben jetzt Wissenschaftler des Max-Planck-Instituts in Frankfurt/Main gemeinsam mit zwei Arbeitsgruppen der Universitäten Freiburg und Osnabrück bis ins molekulare Detail hinein aufgeklärt. Sie berichten in der internationalen Fachzeitschrift Science (Science, 14. März 2003), wie lebensnotwendige Boten-Proteine über zweiporige Kanäle in der inneren Hülle des „Zell-Kraftwerks“ landen. Diese molekularen Einblicke sind sehr wichtig, da schwerwiegende neurodegenerative Erkrankungen wie das Mohr-Tranebjaerg-Syndrom auftreten können, wenn die für den Import der Botenmoleküle verantwortlichen Proteine defekt sind.
Eiweißmoleküle (Proteine) sind nahezu an allen Lebensprozessen beteiligt. Zu Tausenden kommen diese verschiedenen lebenswichtigen Moleküle in jeder Zelle eines Organismus vor. Die Energie für die Arbeit in den Zellen liefern eigene „Kraftwerke“, die Mitochondrien. Jedes dieser „Kraftwerke“ ist von einer inneren und einer äußeren Membranhülle umgeben. Sie arbeiten in allen Lebewesen gleich und steuern die Energieproduktion. Treten Funktionsstörungen in diesen „Kraftwerken“ auf, kann das zu Zellschädigungen bis hin zum Zelltod führen. Ausgelöst werden sie beispielsweise durch eine beeinträchtigte Energieproduktion, einen unausgeglichenen Kalziumhaushalt, oxidativen Stress oder das verhinderte Einschleusen lebenswichtiger Proteine durch die mitochondriale Doppelmembran. In letzterem Fall kann das beim Menschen ein Syndrom auslösen, das bis zur Taubheit führt (Mohr-Tranebjaerg-Syndrom). Deshalb ist es wichtig, die komplexen Mechanismen zum Einschleusen der Proteine in das „Kraftwerk des Lebens“ zu erforschen.
Diverse Proteine werden quasi als „Kraftwerk-Bausteine“ über Multiprotein-Schleusen (Translokasen) in das Mitochondrium transportiert. Die erste Importmaschine ist der so genannte TOM-Komplex, der den Durchgang durch die äußere Membran über eine gemeinsame Pore (GIP, Generelle Import Pore) regelt. Für das Eindringen in die Innenmembran trennen sich dann die Wege, je nachdem, um was für ein Protein es sich handelt. Man unterscheidet zwei große Gruppen von Vorstufenproteinen: spaltbare Proteine mit einem einzigen Signal, ähnlich einer Kennzahl, an einem Ende und nicht spaltbare Boten-Proteine mit mehreren internen Signalen. Die ersten werden durch ihre „Spezial-Pforte“, den sogenannten TIM23-Komplex, eingeschleust. Hingegen erreichen die „Botenträger“ die Innenmembran der „Powerstation“ durch den TIM22-Komplex.
Bisher war nicht bekannt, wie dieser TIM22-Komplex funktioniert. Das konnten die Max-Planck-Forscher jetzt gemeinsam mit ihren Partnern mittels biochemischer, elektronenmikroskopischer und elektrophysiologischer Untersuchungen an einzelnen Komplex-Partikeln ermitteln. Um zu erfahren, was sich genau in dieser „Schleuse“ abspielt, mussten die Wissenschaftler zunächst den Protein-Komplex aus dem Modellorganismus der Bäckerhefe isolieren. Das war nicht leicht, weil dieser essentielle Komplex in der Innenmembran des „Kraftwerkes“ nicht gerade häufig vorkommt. Wissenschaftlern am Institut für Biochemie und Molekularbiologie in Freiburg gelang es jedoch, den TIM22-Komplex in ausreichenden Mengen so sauber aus der Innenmembran herauszulösen, dass die einzelnen Partikel unter dem Elektronenmikroskop sichtbar gemacht werden konnten. Dadurch wurde es erstmalig möglich, diese regulierte Pore der Innenmembran genauer zu beschreiben. Doch die sehr kleinen, nur elf Nanometer langen Einzelpartikel erforderten eine optimierte Methode für ihre Klassifizierung. Diese Charakterisierung gelang dann am Max-Planck-Institut für Biophysik in Frankfurt/M.: Dabei stellte sich heraus, dass die TIM22-„Schleuse“ aus zwei physikalischen Öffnungen besteht. Elektrophysiologische Messungen in der Biophysik der Universität Osnabrück ergaben dann, dass es sich dabei um zwei gekoppelte Transportkanäle handelt.
Der Durchmesser der Kanäle ist nachweislich kleiner als die General Import Pore. Das ist notwendig, weil der Transport über die Innenmembran sehr streng reguliert sein muss, um kein Leck zu riskieren. Denn während des Imports muss das Konzentrationsgefälle (Membranpotential) über der Innenmembran aufrechterhalten bleiben, um weiterhin eine reibungslose Energiegewinnung in der „Powerstation“ zu gewährleisten. In einem ersten Schritt legt das Boten-Protein dann lose – mit Hilfe von kleinen Tim-Proteinen – am TIM22-Komplex an. Im zweiten Schritt dockt es richtig an, wofür es ein bestimmtes Membranpotential benötigt. Doch erst in der dritten Phase wird der Kanal durch maximale Spannung und durch die Gegenwart des zu transportierenden Boten-Proteins voll aktiviert und reguliert. Ist das Boten-Protein dann in der Innenmembran erfolgreich eingebaut, kann es seine Funktion ausüben. Diese besteht unter anderem darin, wie ein „Shuttle“ das ATP als Energiespeicher aus dem Innern des „Kraftwerkes“ zu seinen „Verbrauchern“ nach außen in die Zelle zu transportieren und leere Energiespeicher-Moleküle wieder ins „Kraftwerk“ zurück zu schleusen, um sie dort wieder aufzufüllen.
Dass der Protein-Import in die Mitochondrien einwandfrei funktioniert, ist nicht nur für die einzelne Zelle lebensnotwendig, meint Max-Planck-Forscherin Kirstin Model. Inzwischen gibt es viele Erkrankungen, bei denen die Mitochondrien als Ursache mit in Betracht gezogen werden.
Weitere Informationen erhalten Sie von:
Dr. Kirstin Model
Max-Planck-Institut für Biophysik
Marie-Curie-Str. 15
60439 Frankfurt am Main
Bis 1. April 2003:
Tel.: 0 69 / 6 78 08 – 30 05
Fax: 0 69 / 6 78 08 – 30 02
Ab 1. April 2003:
Tel.: 0 69 / 63 03 – 30 05
Fax: 0 69 / 63 03 – 30 02
E-Mail: Kirstin.Model@mpibp-frankfurt.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Erstmals 6G-Mobilfunk in Alpen getestet
Forschende der Universität Stuttgart erzielen leistungsstärkste Verbindung. Notrufe selbst in entlegenen Gegenden absetzen und dabei hohe Datenmengen in Echtzeit übertragen? Das soll möglich werden mit der sechsten Mobilfunkgeneration – kurz…

Neues Sensornetzwerk registriert ungewöhnliches Schwarmbeben im Vogtland
Das soeben fertig installierte Überwachungsnetz aus seismischen Sensoren in Bohrlöchern zeichnete Tausende Erdbebensignale auf – ein einzigartiger Datensatz zur Erforschung der Ursache von Schwarmbeben. Seit dem 20. März registriert ein…

Bestandsmanagement optimieren
Crateflow ermöglicht präzise KI-basierte Nachfrageprognosen. Eine zentrale Herausforderung für Unternehmen liegt darin, Über- und Unterbestände zu kontrollieren und Lieferketten störungsresistent zu gestalten. Dabei helfen Nachfrage-Prognosen, die Faktoren wie Lagerbestände, Bestellmengen,…





















