Live-Schaltung ins Zellinnere
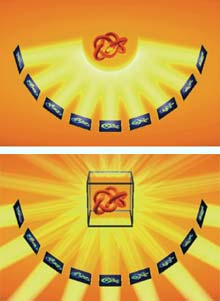
Abb. 1a und 1b: Prinzip der Elektronentomographie: Im ersten Schritt (1a) wird ein Objekt aus vielen unterschiedlichen Winkeln aufgenommen. Im zweiten Schritt (1b) werden die Abbildungen "rückprojiziert" und im Computer zu einem räumlichen Modell zusammengesetzt. <br>Grafik: Max-Planck-Institut für Biochemie <br>
Wissenschaftlern am Max-Planck-Institut für Biochemie gelingt erstmals der Blick in eine intakte, lebende Eukaryotenzelle
Seit über 10 Jahren arbeiten Wissenschaftler in der Abteilung Molekulare Strukturbiologie von Wolfgang Baumeister an der Entwicklung der Elektronentomographie – ein Verfahren, bei dem die Elektronenmikroskopie mit automatisierten Bildaufzeichnungsverfahren und neuer Bildanalysetechnik kombiniert wird. So konnten sie bereits in das Innere von Bakterienzellen schauen und Zellbestandteile wie Membranen und Molekülkomplexe dreidimensional darstellen. Erstmals gelang es ihnen nun auch Bilder aus dem Zellinneren eines Vielzellers, des Schleimpilzes Dictyostelium discoideum, zu präsentieren und damit den Beweis anzutreten, dass es auf diesem Wege tatsächlich möglich ist, Momentaufnahmen von Zellen höherer Organismen zu erhalten. Ihre Ergebnisse haben die Martinsrieder Forscher in der aktuellen Ausgabe von Science (8. November 2002) veröffentlicht.
Wenn Wissenschaftler die Vorgänge verstehen wollten, die in einer Zelle ablaufen, mussten sie bisher langwierige Isolationen, Reinigungen und Präparationen durchführen, um einzelne Bestandteile der Zelle sichtbar zu machen oder die Funktion der einzelnen Bestandteile in vitro, d.h. im Reagenzglas, zu untersuchen. Aus der Kenntnis der Funktionen und Strukturen einzelner Bestandteile und Organellen einer Zelle versuchten die Wissenschaftler auf die eigentlichen Abläufe in der lebenden Zelle zu schließen. Dabei mussten sie allerdings mögliche Verfälschungen ihrer Ergebnisse hinnehmen, die durch Artefakte bei der Präparation (Entwässerung, chemisches Fixieren oder Färbung) hervorgerufen werden können. Die technischen Möglichkeiten erlaubten es bisher nicht, in die lebende Zelle hinein zu schauen und Momentaufnahmen ihres Innenlebens darzustellen. Wolfgang Baumeister hat mit seinen Kollegen ein Verfahren entwickelt, mit dem es gelingt, Zellbestandteile und Molekülkomplexe in der lebenden Zelle sichtbar zu machen. Dadurch wird es jetzt erstmals möglich, die Kommunikation und die Wechselwirkungen einzelner Zellorganellen bzw. Zellstrukturen in der natürlichen Umgebung im Organismus – in vivo und das heißt live – zu studieren.
Das von den Martinsrieder Wissenschaftlern entwickelte Verfahren – die Elektronentomographie – unterscheidet sich nicht prinzipiell von anderen tomographischen Bildgebungsverfahren, wie sie etwa in der Medizin (Computertomographie) angewandt werden: Von einem Objekt werden am Elektronenmikroskop Bilder aus verschiedenen Blickwinkeln und in verschiedenen Ebenen aufgenommen. Aus diesen verschiedenen zweidimensionalen Bildern lässt sich ein dreidimensionales Bild rekonstruieren (Abb.1). Im Gegensatz jedoch zur Computertomographie in der Medizin wird bei der Elektronentomographie das zu untersuchende Objekt im Strahl des Elektronenmikroskops gekippt, während die „Lichtquelle“, also die Quelle der Elektronenstrahlen, an ihrem Platz verbleibt.
Objekte, die elektronentomographisch untersucht werden sollen, werden zunächst schockgefroren (vitrifiziert) und in amorphem Eis beobachtet. Sie sind völlig intakt; Artefakte, also Störungen durch eine Präparation, werden bei diesem Verfahren vermieden. Die natürlichen Proben sind jedoch außerordentlich strahlenempfindlich, daher versuchen die Wissenschaftler die Dauer der Bestrahlung so kurz wie möglich zu halten. Andererseits möchten die Forscher möglichst viele Bilder aus verschiedenen Winkeln aufnehmen – erst das erhöht die Qualität der 3D-Rekonstruktion, sie wird präziser. Mit ihrer automatisierten Technik ist es Baumeister und seinen Kollegen gelungen, ein Optimum an Auflösung und Qualität zu erreichen. Dabei mussten die Wissenschaftler zunächst umfangreiche Vorarbeiten leisten: So stellten sie z. B. künstliche Zellen her und füllten sie mit Proteinkomplexen, die sie aus natürlichen Zellen isoliert hatten und deren Struktur bereits bekannt war. An diesen künstlichen Zellen optimierten und automatisierten die Forscher die elektronenmikroskopischen Aufnahmen und die Bildanalyse. Die theoretischen Grundlagen zur Datenbearbeitung publizierten Achilleas S. Frangakis und seine Kollegen aus der Baumeister-Abteilung in der neuesten Ausgabe der Proceedings of the National Academy of Sciences of the USA (PNAS, 29. Oktober 2002).
Bei der erstmaligen Untersuchung eines Eukaryoten (seine Zellen besitzen im Gegensatz zu Bakterien einen Zellkern), stellten die Wissenschaftler nun zu ihrem Erstaunen fest, dass eine eukaryotische Zelle nicht so dicht gepackt ist, wie ursprünglich angenommen, und dass die einzelnen Proteinkomplexe der Zelle deshalb auch gut zu visualisieren sind. Das Team mit Ohad Medalia, Igor Weber, Achilleas Frangakis, Daniela Nicastro, Günther Gerisch und Wolfgang Baumeister konnte zwischen 300 und 600 Nanometer dünne Zellregionen elektronentomographisch untersuchen (1 Nanometer sind ein Millionstel Millimeter) und dabei erstmals ein mit Ribosomen besetztes Endoplasmatisches Reticulum (raues ER) – ein Membrannetzwerk in Eukaryotenzellen, das Proteine und neue Membranen produziert – klar und deutlich in der intakten Zelle sichtbar machen (Abb.2).
Darüber hinaus konnten die Wissenschaftler auch ein ihnen bereits vertrautes Studienobjekt identifizieren, das 26S Proteasom, ein Proteinkomplex, der am Abbauprozess von Proteinen beteiligt ist. Baumeister hatte vor einigen Jahren zusammen mit seinen Kollegen die Struktur dieser molekularen Maschine an Exemplaren aufgeklärt, die die Wissenschaftler aus Froschzellen isoliert hatten. Sie fanden nun eine deutliche Übereinstimmung in der Struktur.
Die großartigsten Bilder erhielten die Wissenschaftler jedoch von Proteinen, die das Skelett der Zelle bilden – den so genannten Aktinfilamenten. Diese Strukturproteine durchziehen, quasi wie Fäden, das gesamte Zellinnere. Sie stabilisieren die Form der Zelle, sind für ihre Fortbewegung unerlässlich und an wesentlichen intrazellulären Transport-Prozessen beteiligt. In der aktuellen Science-Ausgabe haben die Wissenschaftler jetzt erstmals Aufnahmen dieses so genannten Cytoskeletts von Dictyostelium veröffentlicht, wie es tatsächlich in der Zelle angeordnet ist. Die Aufnahmen zeigen, dass es zwischen den einzelnen Filamenten zu Brückenbildungen kommt, dass die verschiedenen Aktinstränge in unterschiedlichen Winkeln zueinander verknüpft sind und dass sie auch mit der Zellmembran verbunden sind.
„Die Elektronentomographie eröffnet uns nun die Möglichkeit, eine vollständige Beschreibung der räumlichen Interaktionen von Proteinkomplexen in der Zelle wiederzugeben“, so Baumeister. Die Erkenntnisse aus der Strukturbiologie, Zellbiologie und Enzymkinetik, die bisher an isolierten Molekülen und Zellstrukturen gewonnen wurden, können nun in der Synthese durch die Elektronentomographie zusammengeführt werden. „Unser Ziel ist es, das komplexe Modell der gesamten Zelle zu beschreiben, nicht nur die Funktionen einzelner Moleküle und Organellen, wie es bisher möglich war, sondern der gesamten Zellstrukturen. Durch die Elektronentomographie können wir Belege für Theorien liefern, die Wissenschaftler in der Vergangenheit nur anhand der Struktur der einzelnen Komponenten aufgestellt hatten.
Beide Publikationen, die in Science als auch die in PNAS gelten als Durchbrüche in der Zellbiologie
Originalpublikationen:
Medalia O, Weber I, Frangakis A S, Nicastro D, Gerisch G, Baumeister W (2002): Macromelcular Architecture in Eukaryotic Cells Visualized by Cryoelectron Tomography. Science, 8. Nov. 2002-11-07
Frangakis A S, Böhm, J, Förster J., Nickell S, Nicastro D, Typke D, Hegerl R, Baumeister W (2002): Identification of Macromolecular Complexes in Cryoelectron Tomograms of Phantom Cells. PNAS 99 (22): 14153-14158. 29. Okt. 2002.
Weitere Informationen erhalten Sie von:
Eva-Maria Diehl
Max-Planck-Institut für Biochemie
Am Klopferspitz 18a
82152 Martinsried
Tel: 089 – 8578 – 2824
Fax: 049 – 89 8578 – 2943
diehl@biochem.mpg.de
Media Contact
Weitere Informationen:
http://www.biochem.mpg.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















