Alzheimer-Auslöser gibt Geheimnis seiner pathologischen Struktur preis

Alzheimer! Diese Diagnose ist für Betroffenen und ihre Angehörigen ein großer Schock. Gedächtnisverfall, Orientierungslosigkeit und Erkennungsstörungen gehören zu den gefürchteten Symptomen. Im fortgeschrittenen Stadium dieser neurodegenerativen Demenz-Erkrankung drohen Persönlichkeitsverlust und soziale Isolation. Der Grund des mentalen Verfalls: Nervenzellen im Hirn sterben ab.
Obwohl die Auslöser der zugrunde liegenden neurodegenerativen Prozesse weitgehend bekannt sind, ist diese Krankheit noch immer unheilbar: Proteinablagerungen aus so genannten ß-Amyloid-Peptiden, die sich als „Plaque“ oder in Form faserartiger Fibrillen im Nervengewebe des Gehirns ablagern.
Am Leibniz-Institut für Altersforschung – Fritz-Lipmann-Institut (FLI) in Jena gelang es nun, die bisher genauesten Strukturbilder solcher ß-Amyloid-Fibrillen elektronenmikroskopisch zu erzeugen. Dr. Marcus Fändrich und Dr. Carsten Sachse haben in Kooperation mit Prof. Nikolaus Grigorieff von der amerikanischen Brandeis Universität ein Verfahren entwickelt, das auf der Grundlage computergesteuerter Bildgebungsverfahren hochauflösende Aufnahmen solcher Proteine am Kryo-Elektronenmikroskop erlaubt. Diese Bilder – in einer Auflösung von unter 10 Angström – geben Aufschluss über Form und Struktur der ß-Amyloid-Fibrillen, die Bestandteil der „Plaques“ sind und als Auslöser der Alzheimer-Krankheit gelten. Bisher gab es nur modellhafte Vorstellungen, die mit Hilfe dieser Aufnahmen nun experimentell geprüft werden können.
Bereits der Arzt Alois Alzheimer, der dieses Krankheitsbild 1906 der Fachöffentlichkeit vorstellte, hatte am Mikroskop entdeckt, dass abgestorbene Nervenzellen im Gehirn der Patienten von einer merkwürdigen Substanz umlagert waren. Heute weiß man: Diese Substanz – ß-Amyloid genannt – entsteht aus einem Protein, das an der Oberfläche der Zellen abgespalten wird. Über mehrere Stufen entstehen aus den Abspaltungen zunächst kleinere Fibrillen-Vorläufer, sodann immer größere Fibrillen-Komplexe, die schließlich zu Amyloid-Plaques verklumpen. Entscheidend für Therapie und Vorbeugung ist die Frage, welcher dieser Proteinkomplexe den Nervenzellen gefährlich werden kann. Schädigen bereits die Vorstufen das Nervengewebe oder sind es vor allem die Plaques, die die Neurodegeneration hervorrufen? Auch an dieser entscheidenden Frage wird am Leibniz-Institut für Altersforschung (Fritz-Lipmann-Institut) in Jena geforscht.
So wurde in der Forschergruppe von PD Dr. Marcus Fändrich in Zusammenarbeit mit Dr. Uwe Horn und Kollegen vom Hans-Knöll-Institut (HKI) in Jena ein spezifischer Antikörper gewonnen, der nur die Fibrillen-Komplexe erkennt, nicht jedoch die Fibrillen-Vorläufer. Dieser Antikörper kann nicht nur zur Diagnose eingesetzt werden. In Zellkultur verhindert er die Bildung von größeren Proteinverklumpungen, wie sie in den Alzheimer-Plaques vorkommen. Im nächsten Schritt werden diese Antikörper an Alzheimer-Mäusen getestet. Hierzu werden nun in der Forschergruppe von Dr. Christoph Kaether geeignete Maus-Modelle entwickelt. „Sollte es uns gelingen, mit Hilfe dieser Antikörper die Amyloid-Fibrillen an der Verklumpung zu hindern, können wir herausfinden, ob damit die Krankheitssymptome ausbleiben oder gar verstärkt werden“, so Kaether. Eine Verstärkung der Krankheitssymptome würde darauf hindeuten, dass bereits die Fibrillen Nervenzellen töten und nicht erst die Plaques. „Für die Alzheimer-Forschung und -Therapie wäre dies ein äußerst vielversprechender Fortschritt“, kommentiert FLI-Direktor Prof. Dr. Peter Herrlich.
Kontakt:
Dr. Christoph Kaether
Leibniz-Institut für Altersforschung – Fritz-Lipmann-Institut (FLI) Jena
ckaether@fli-leibniz.de; Tel.: 0 36 41 / 65 62 30
Originalveröffentlichungen:
Paired ß-sheet structure of an Aß(1-40) amyloid fibril revealed by electron microscopy.
Sachse C, Fändrich M, Grigorieff N
Proc Natl Acad Sci USA. 2008, 105, 7462-7466.
Directed selection of a conformational antibody domain that prevents mature amyloid fibril formation by stabilizing Aß?protofibrils.
Habicht G, Haupt C, Friedrich RP, Hortschansky P, Sachse C, Meinhardt J, Wieligmann K, Gellermann GP, Brodhun M, Götz J, Halbhuber KJ, Röcken C, Horn U, Fändrich M.
Proc Natl Acad Sci USA. 2007, 104, 19232-19237.
Media Contact
Weitere Informationen:
http://www.fli-leibniz.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…
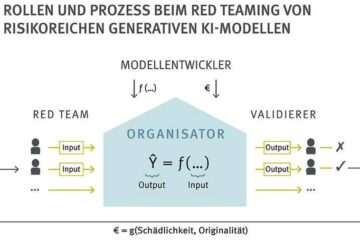
So soll risikoreiche generative KI geprüft werden
Die beschlossene KI-Verordnung der EU sieht vor, dass Künstliche-Intelligenz-Modelle (KI) „für allgemeine Zwecke mit systemischem Risiko“ besonders strikt überprüft werden. In diese Modellkategorie gehören auch populäre generative KI-Modelle wie GPT4…