Wie Bakterien Spritzen bauen
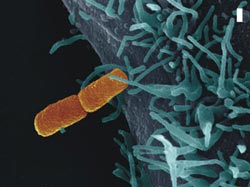
Shigella flexneri, der Erreger der Bakterienruhr (orange), nimmt Kontakt mit einer menschlichen Wirtszelle (blau) auf. Der Balken entspricht einem Mikrometer bzw. einem tausendstel Millimeter. Bild: Volker Brinkmann, Diane Schad und Michael Kolbe<br>
Für eine erfolgreiche Infektion müssen Bakterien das Immunsystem ihres Wirts gezielt austricksen. Dazu produzieren sie sogenannte Virulenzfaktoren und leiten diese über ein Transportsystem in der Bakterienmembran nach außen. Bei einigen Bakterien ist dieses Transportsystem wie eine Spritze gestaltet. Die Virulenzfaktoren können auf diese Weise direkt in die Wirtszelle injiziert werden. Erstmals ist es jetzt Max-Planck-Wissenschaftlern in Zusammenarbeit mit dem Bundesinstitut für Materialforschung und -prüfung gelungen, grundlegende Mechanismen zu klären, nach denen dieses Transportsystem zusammengebaut wird. Diese Erkenntnisse sind ein wichtiger Schritt für die Entwicklung von Wirkstoffen, die wesentlich früher als Antibiotika in den Verlauf einer Infektion eingreifen könnten. (Nature Structural & Molecular Biology, 13. Juni 2010)
Jeden Tag ist der menschliche Organismus dem Angriff verschiedenster Krankheitserreger ausgesetzt (Abb. 1). Die meisten Erreger werden dabei durch unser Immunsystem abgewehrt. Um eine erfolgreiche Infektion durchzuführen, müssen Bakterien daher die Zellen ihres Wirts manipulieren, so dass ihr eigenes Überleben gewährleistet ist. Zu diesem Zweck schleusen Bakterien über ein Transportsystem in der Bakterienmembran gezielt Virulenzfaktoren in die Wirtszelle ein. Einige Bakterien, wie die Erreger von Bakterienruhr, Lebensmittelvergiftung, Typhus und Pest, haben dabei ein besonderes Transportsystem entwickelt, das als als Typ-III-Sekretionssystem bezeichnet wird. Unter dem Elektronenmikroskop sieht dieses Sekretionssystem wie eine Spritze aus, wobei der Spritzenkörper in die Bakterienmembran eingebettet ist und die Nadel nach außen weist (Abb. 2). Die Bakterien können mit Hilfe dieser Nano-Spritzen die Virulenzfaktoren direkt in die Wirtszelle injizieren.
Wie die Bakterien diese Nano-Spritze aufbauen, war bisher weitestgehend unbekannt. Wissenschaftler des MPI für Infektionsbiologie in Berlin und des MPI für biophysikalische Chemie in Göttingen haben es jetzt zusammen mit dem Bundesamt für Materialforschung und -prüfung geschafft, grundlegende Mechanismen des Zusammenbaus der Spritze zu entschlüsseln. Diese Analysen waren möglich, weil es den Forschern gelang, den Spritzenapparat im Reagenzglas nachzubauen. Die nähere Untersuchung dieser Vorgänge zeigte, wie die Proteine zu einer Hohlnadel zusammengebaut werden: Das Bakterium synthetisiert die Proteine in seinem Zellinneren, schleust sie durch die Spritze nach außen und setzt sie eines nach dem anderen auf die Spitze der wachsenden Nadel. Auch konnten die Wissenschaftler zeigen, dass die Proteine beim Zusammenbau der Nadel ihre räumliche Struktur ändern. Es gelang ihnen, die Strukturänderungen während des Nadelaufbaus für jede Aminosäure des Proteins genau zu verfolgen.
Diese Erkenntnisse eröffnen einen Ansatzpunkt für die Entwicklung von Medikamenten, die zu einem sehr frühen Zeitpunkt der Infektion wirken könnten. Diese Wirkstoffe, Antiinfektiva genannt, könnten bereits den Aufbau der Spritze und das Einschleusen von Virulenzfaktoren in die Wirtszelle verhindern. Dies wäre ein wesentlicher Vorteil gegenüber Antibiotika, die erst durch die Membran in das Zellinnere der Bakterien müssen, um ihre Wirkung zu entfalten. Ein weiterer Nachteil von Antibiotika ist, dass diese nicht zwischen „bösen“, also krankmachenden, und guten Bakterien unterscheiden. Dies führt in der Praxis oft zu unerwünschten Nebenwirkungen. Auch das Problem der Entwicklung von Antibiotikaresistenzen könnte mit solchen Antiinfektiva umgangen werden.
Die Strukturänderung des Nadelproteins während des Spritzenaufbaus wurde durch Röntgenstrukturuntersuchungen am BESSY in Berlin und am ESRF in Grenoble sowie durch komplementäre NMR-spektroskopische Untersuchungen in flüssiger und fester Phase am Max-Planck-Institut für biophysikalische Chemie in Göttingen (Abteilung Griesinger) untersucht. Dabei verglichen die Wissenschaftler die dreidimensionale Struktur des Nadelproteins vor und nach der Entstehung der Nadel.
Originalveröffentlichung:
Ömer Poyraz, Holger Schmidt, Karsten Seidel, Friedmar Delissen, Christian Ader,
Hezi Tenenboim, Christian Goosmann, Britta Laube, Andreas F. Thünemann, Arturo
Zychlinsky, Marc Baldus, Adam Lange, Christian Griesinger, and Michael Kolbe:
Protein refolding is required for assembly of the Type three secretion needle
Nature Structural & Molecular Biology, 13. Juni 2010
Weitere Informationen erhalten Sie von:
Dr. Michael Kolbe
Max-Planck-Institut für Infektionsbiologie, Berlin
Tel.: +49 30 28460 332
Fax: +49 30 28460 301
E-Mail: kolbeof@mpiib-berlin.mpg.de
Dr. Adam Lange
Max-Planck-Institut für biophysikalische Chemie, Göttingen
Tel.: +49 551 201 2214
Fax: +49 551 201 2202
E-Mail: adla@nmr.mpibpc.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern-befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















